Bonjour à tous
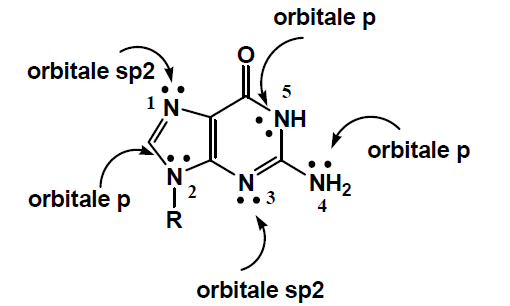
J'aurais une question sur l'hybridation du doublet non liant de l'azote 4 et 5
Cet atome est hybridé sp3, ses 4 orbitales sont donc forcément sp3 je ne comprends pas comment le doublet non liant peut il etre dans une orbitale p ?
Merci d'avance
-----