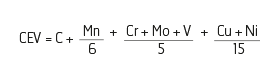Bonjour à tous les chimistes dans la salle,
En effectuant des recherches sur internet je suis tombé sur vos fils de discussion et afin de répondre a mes interrogations je me permets ces quelques questions :
Je cherche a savoir quel effet a le sulfate de cuivre (CuSO4 ) au contact d'un acier , en l'occurrence Cor-ten .
Quel est mon but me direz vous ? Je cherche a accélérer la corrosion superficielle d'une tôle Cor-ten afin de stabiliser son état, en effet la tôle brute et calaminée met un temps assez long pour débuter son oxydation de surface.(2-3ans)
J'ai également lu cette solution :
- Peroxyde d'hydrogène (H2O2)
- Sel (Na)
- vinaigre ( acide acétique CH3COOH)
Pourriez-vous m'aider a comprendre ces phénomènes et par ce biais m'aiguiller vers la solution ?
Par avance merci pour votre aide !
-----