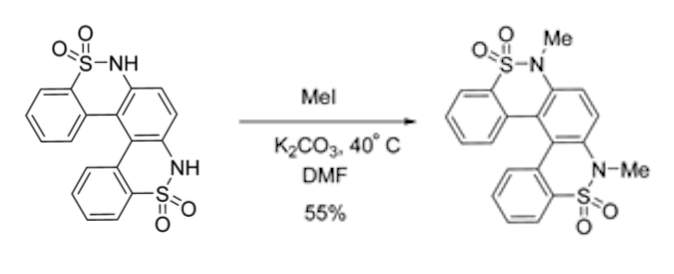
Bonjour, j'ai un gros doute sur le mécanisme de cette réaction j'hésite entre deux possibilités:
La premiere possibilité est que le N vient attaquer le Me ce qui nous donne N+ et ensuite le K2CO3 viendrait déprotoner le N.
La deuxième possibilité est que le K2CO3 viendrait tout d'abord déprotoner le N on aurait donc une charge - qui apparaitrait sur le N, le N étant plus nucleophile il viendrait attaquer le Me.
Je pencherai plus sur la deuxième possibilité mais je ne sais pas vraiment pourquoi l'une serait plus probable que l'autre. Est ce que quelqu'un pourrait m'éclairer s'il vous plaît?
PS: j'ai oublié de dire que c'est une Sn2.
-----