Bonsoir,
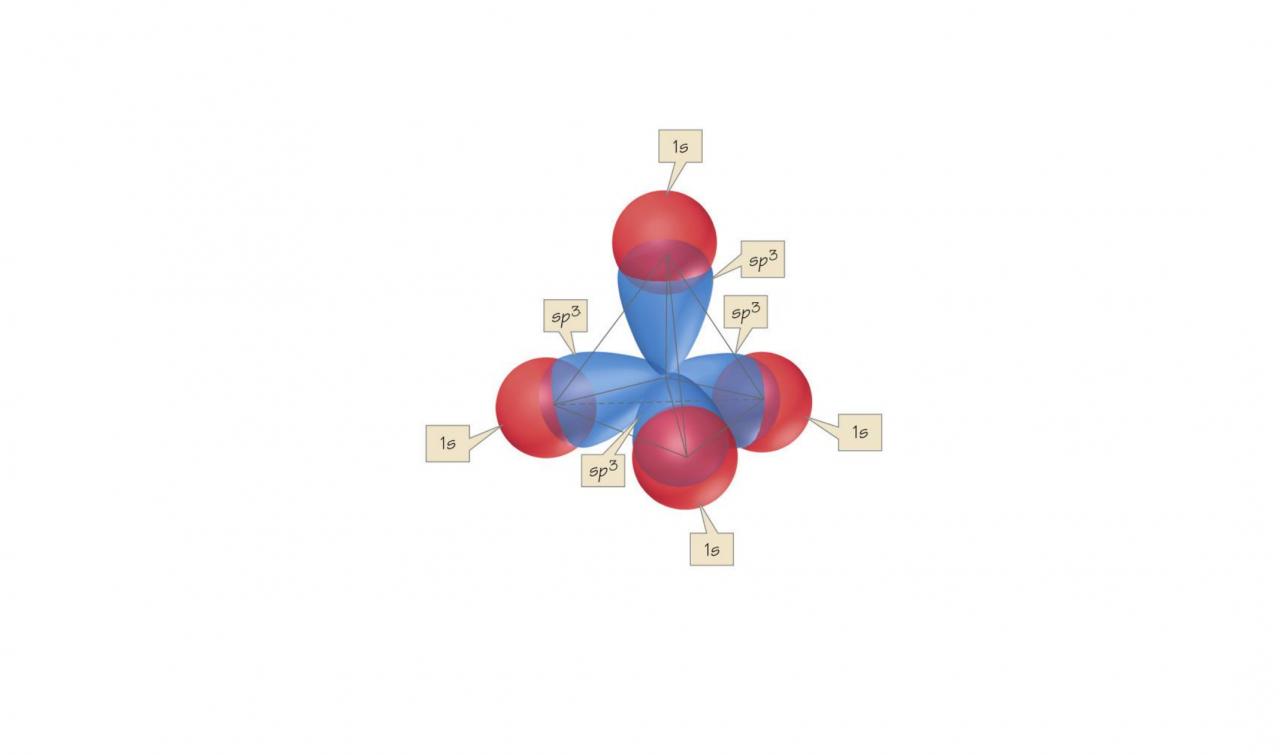
Dans mon cours de chimie, j'ai cru comprendre que pour l'hybridation sp3, les orbitales 1s indiquées sur l'image ci-dessous doivent être négligées. Sinon on ne pourrait pas hybrider ( l'exemple est pour CH4 ) . Je ne comprends pas pourquoi il faudrait négliger ces orbitales sphériques puisque,à priori, la densité de présence d'un électron n'est pas nulle dans ces lobes ( orbitales s ).
Merci d'avance.
-----


