Bonjour,
Je suis en train de revoir une leçon sur l’électrophorèse en m’aidant d’une vidéo sur Youtube pour mieux comprendre.
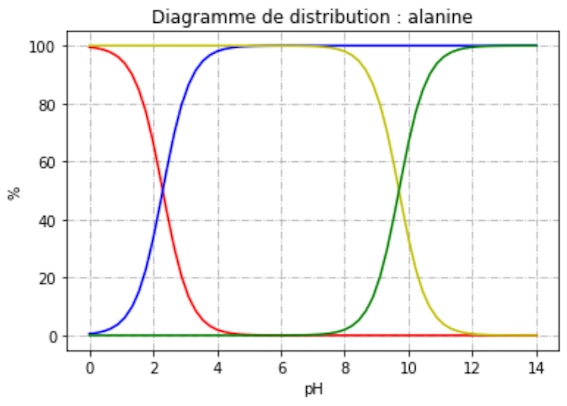
À un moment de la vidéo, il est dit que l’alanine a un pHi de 6, et qu’avec une solution à pH= 6,5 l’alanine sera électriquement neutre et ne migrera pas ou presque pas.
Si on parlait d’une protéine entière avec plein de sites d’ionisation je comprendrais qu’il puisse y avoir divers degrés de migration, mais là, avec l’alanine toute seule, qui n’en a que deux (son COOH et son NH3), je ne comprends pas. Pour moi, soit le pH de la solution est égal à son pHi et elle a COO- et NH3+ (donc charge globale neutre), soit il dépasse son pHi donc l’alanine relargue ses protons et on a COO- et NH2 donc charge globale négative, soit il est inférieur à son pHi et on a COOH et NH3+ donc charge globale positive. C’est bien ça ?
Si j’ai bien compris, alors je ne vois pas pourquoi on parle de neutralité de l’alanine à pH 6.5 alors que son pH est de 6 (ça me rappelle la blague quand on dit qu’une femme est "un petit peu enceinte", soit elle l’est soit elle ne l’est pas). L’alanine ne peut pas lâcher "un petit peu" le proton du COOH et ainsi devenir "un petit peu" négative, soit elle le lâche et la molécule devient globalement négative, soit elle le garde... Du coup je ne comprends pas pourquoi l’alanine migrerait moins sous prétexte que le pH est relativement proche de son pHi et migrerait davantage si la différence pH/pHi était plus marquée, puisque dans les deux cas il s’agit de la même configuration COO- et NH2, que le pH soit de 6,5 ou de 15.
Qu’est-ce que j’ai raté dans le raisonnement ? Merci d’avance pour votre aide !
-----



 , ce qui donne immédiatement le rapport. On obtient :
, ce qui donne immédiatement le rapport. On obtient :