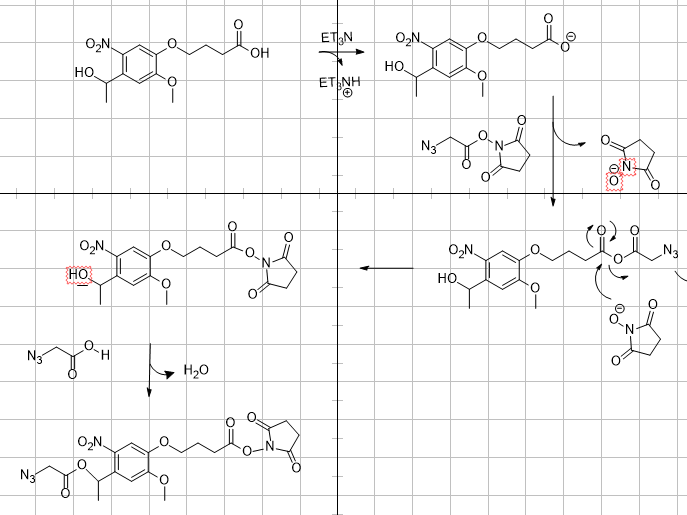
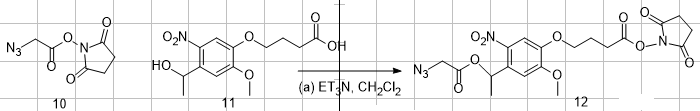
Bonjour à tous,
j'ai une question. Je cherche pour un projet le mécanisme de la réaction suivante :
J'arrive à la fin à une estérification mais je suis en milieu basique. Est ce que quelqu'un peut m'aider s'il vous plaît?
Dans le milieu j'ai seulement ET3N et CH2CL2.
Merci de votre aide !
-----