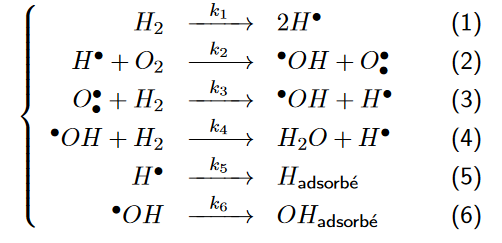Bonjour à tous!
Voici une vielle question à laquelle je ne trouve de réponse depuis plusieurs années
Le sujet est extrêmement simple vous me direz...
Si on apporte de l'énergie à un gaz contenant exclusivement du dioxygène et du dihydrogène, ça fait boom
L'équation de la réaction est la suivante: excitation + H² + O² => 2x H²0 + Chaleur
J'ai du mal à comprendre d'ou vient toute cette énergie en fin de réaction alors j'ai essayé de décomposer en étapes suite à mes recherches sur internet
Question: Voici ce que je devine de la séquence. Pouvez vous me corriger s'il vous plait?
1)- Excitation des deux électrons de la molécule H² en fournissant un peu d'énergie
2)- Les deux électrons se libèrent et retombent sur des molécules O²
3)- Les deux protons du H² ne sont plus neutralisés par leurs électrons et se repoussent violemment, cassant la molécule
4)- Les deux noyaux d'oxygène du O² ne sont plus neutralisés par leurs électrons et se repoussent violemment, cassant la molécule
5)- Les Protons retombent violemment sur des atomes d'oxygène libres et le choc de la chute devient de l'agitation thermique
6)- L'énergie thermique globale du milieu a augmenté
Maintenant dans la réaction inverse, le craquage de l'eau, il me semble que ma logique ne fonctionne pas, ce qui me fait penser que je suis dans l'erreur...
1)- Électrolyse de l'eau
2)- les molécules d'eau reçoivent de l'énergie électrique qui augmente leur agitation thermique au point que des électrons soient éjectés
3)- Deux protons sont alors ensuite éjectés de la molécule d'eau car l'ensemble n'est plus neutre
4)- Les protons restent isolés jusqu'à ce qu'un électron se fasse capturer
5)- Deux hydrogènes s'associent en H² pendant que deux Oxygènes s'associent en O² grâce aux liaisons de covalence
6)- L'énergie thermique du milieu est sensé avoir diminué mais je ne voit pas pourquoi/comment...?
Merci beaucoup pour votre aide
-----