Bonjour,
J'étais entrain de faire un exercice de thermo (niveau sup) et je ne comprends pas la justification du corrigé (on calcule la variation d'enthalpie au cours d'une transformation avec un changement d'état) :
Je comprends la première égalité qui vient du fait que l'enthalpie est une fonction d'état et la deuxième, pour moi n'est que l'application des lois de Joules pour une phase condensée et la définition de la chaleur latente de vaporisation et de fusion qui est juste l'enthalpie d'un état moins l'enthalpie de l'autre ce qui correspond bien à la variation d'enthalpie que l'on cherche.
Il n'y a nul part besoin d'avoir un transformation isobare àmha.
Serait-ce le corrigé qui se trompe ? Ou moi qui est raté une notion importante ?
Merci d'avance
-----



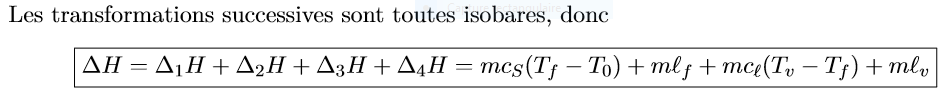



 pour les transformations impliquant des changement de phase.
pour les transformations impliquant des changement de phase.