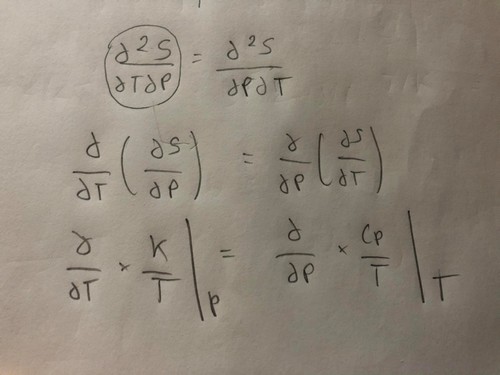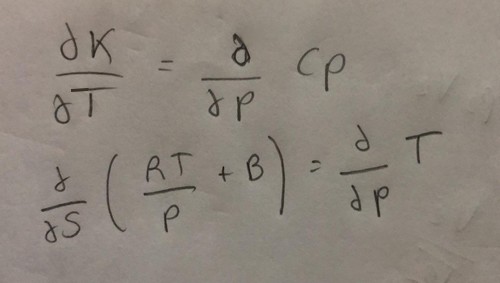Bonjour à tous j'ai un problème et je bloque car j'ai du mal à saisir l'énoncé de celui-ci
Il est dit l'équation d'état de l'azote entre 0 et 150 degré et 0 à 50 bar peut s'écrire P(V-B)=RT (1)
où B = b - β/𝑇^n (2)
avec b=32*10^-6, β=0.204, n=1.5, R=8.314 J/mole.K
Et la relation qui lie la capacité calorifique à pression constante pour une mole :
𝐶𝑝 = 30 + 35.5 × 10^−8𝑃 (3)
Il est demandé d'établir l'expression entre les variations de Cp (3) avec P et de B avec T (j'ai copié collé l'énoncé)
et ensuite de calculer la constante β de l'équation (2) et comparer à la valeur de l'énoncé 0.204.
Je sais qu'il faut s'aider des propriétés suivantes : dU et dS sont des différentielles totales exactes
J'ai du mal à comprendre ce que je dois exprimer en fonction de quoi.
En établissant l'équation différentielle totale de la viariation d'énergie interne
dU= (dU/dT)dT à v=cst + (dU/dV)dT à T=cst = Cv*dT
et
dS= 1/T(dU/dT)dT à v=cst + (1/T(dU/dV) à T=cst + P/T)dV
Avec Cp et dH/dT à P=cst
et Cv = dU/dT ) V=cst
Merci de votre aide
-----