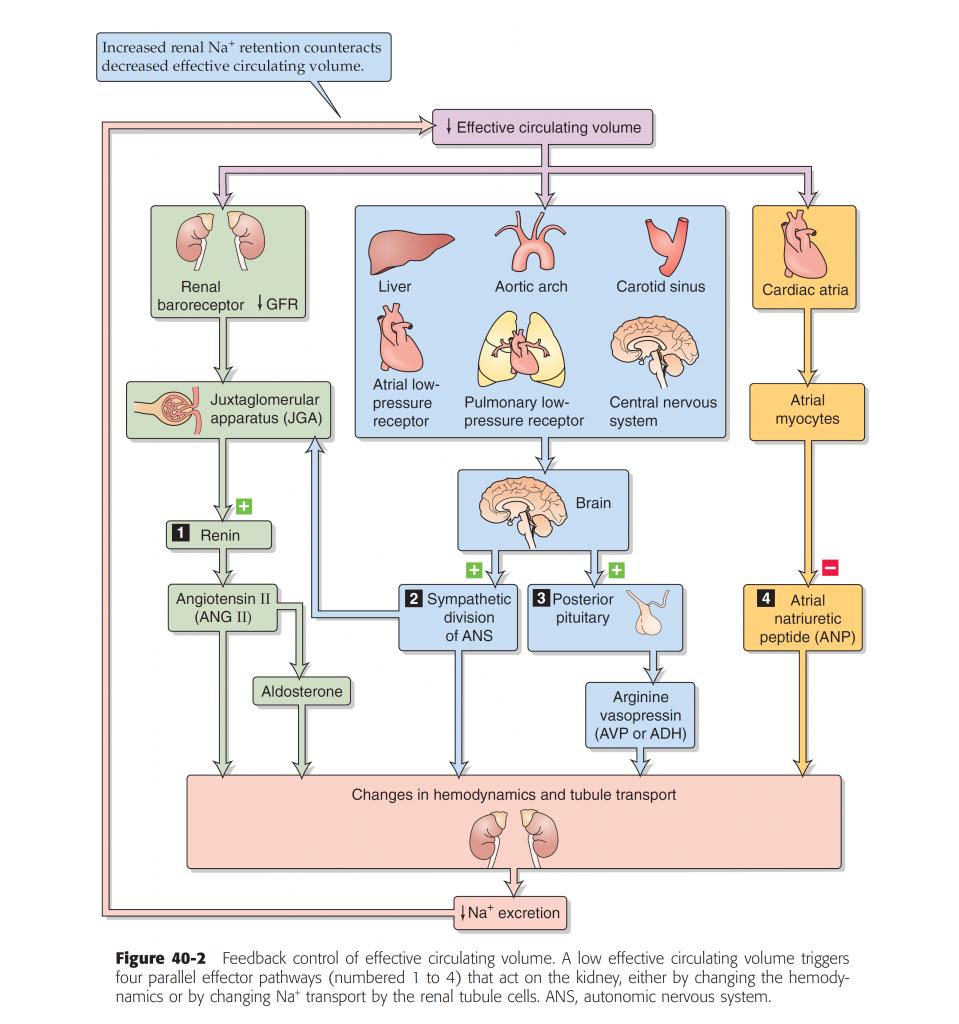
Bonjour,
Le système Rénine Angiotensine a pour effet de vasoconstricter l'artériole efférente.
Hors, si je ne me trompe pas le DFG est augmenté par :
- la vasoconstriction de l'artère efférente
et/ou
- la vasodilatation de l'artère afférente.
Mon problème est dans le cadre d'une Insufisance rénale aigue fonctionnelle, comment se fait il que l'activation du SRA ( par l'hypovolémie) aille vasoconstricter l'artère efférente ( ce qui à mon sens a donc effet d'augmenter le DFG ).
Du coup l'activation du SRA a ici un effet délétère sur l'hypovolémie ?.. Ca aussi ça sonne faux...
Merci de m'éclairer
-----