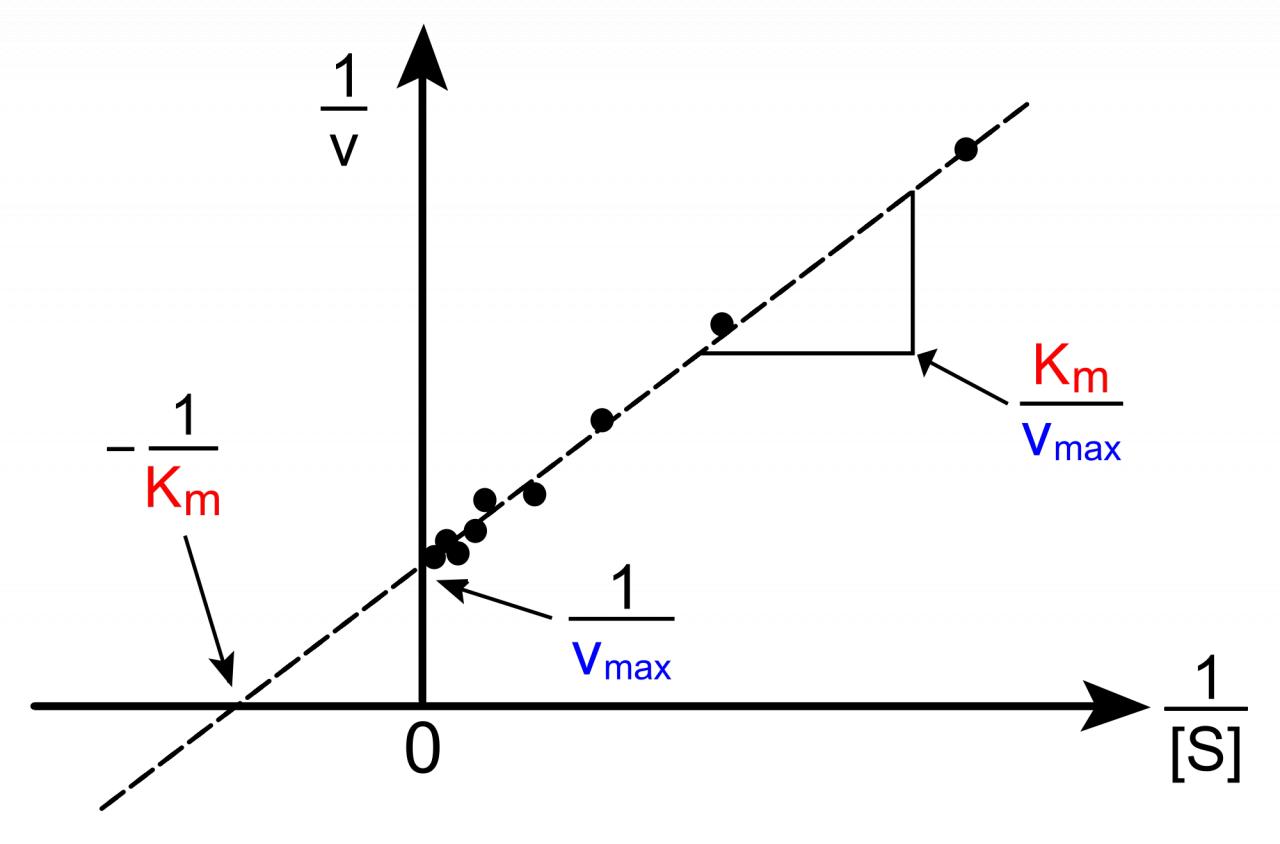
bonjour,
j'ai une question qui me taraude, en fait quelle est l'utilité de la courbe de Michaelis, je me dis qu'on peux calculer la Vmax ainsi que toutes les vitesses initiales, pour des concentrations de substrat données dans les conditions expérimentales, or que mon prof m'as dis qu'il servait a trouver la Vmax et le Km
Donc, au départ quels sont nos inconnus (et que veut-on trouver) à partir de notre courbe?
Merci d'avance.
-----