Bonsoir j'ai un petit problème avec un exercice pour trouver le Ph... si quelqu'un pouvait m'aider svp...
L'acide ascorbique ou vitamine C est souvent vendu en pharmacie sous l'apellation commerciale " Vitascorbol 500" La molècule a pour formule C6H8O6.
On dissout un comprimé de Vitascorbol dans 100ml d'eau distillée et on obtient la solution A que l'on dose par phmetrie par une solution B de soude a 0.33mol/L
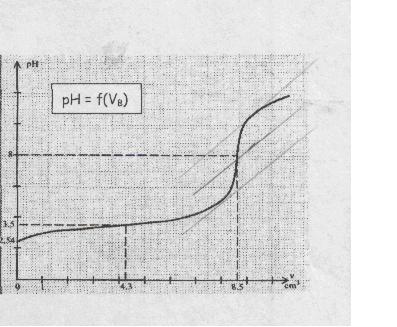
Les mesure sont représenté sur le graph ci dessou :
1) a)L'acide ascorbique est t- il un acide fort ou faible??
j'ai dit que s'était un acide faible car pka>0
b) quel est pka du couple : 3.5
2) a)Ecrire l'equation de réaction :
C6H8O6 + OH- = C6H8O6- + H2O
b) deduire graphiquement Veq
Veq = 8.5 ml
c) En deduite la quantité de matière et la masse d'acide ascorbique contenu dans un comprimé.
On sait que na = nb donc m = Ca*Va*M
m = 0.33*8*10^-3*176 = 0.493g
3) calculer le ph de la solution :
je vous passe la demonstration
Ca= m/ (M*Vfiole)= 0.02805 mol/L
pH = 1/2 (pka- log Ca)
Ph = 2.53
il me demande de le verifier sur le graph , comment on peut faire??
merci d'avance
-----