Bonjour,
Je voudrai savoir quelles sont toutes les valences possibles de l'atome de soufre ?
Donnée: Numéro atomique du soufre: Z=16.
Merci d'avance.
-----

Bonjour,
Je voudrai savoir quelles sont toutes les valences possibles de l'atome de soufre ?
Donnée: Numéro atomique du soufre: Z=16.
Merci d'avance.






Je l'ai appris...
Bon tu peux voir ça en considérant la structure électronique du soufre :
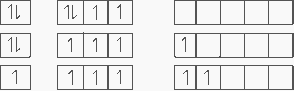
dans le schéma joint j'ai mis les trois config électroniques possibles pour le soufre
Dans la première config on a 2 électrons célibataires donc 2 liaisons possibles.
Dans la deuxième 4
et dans la dernière 6
Le soufre peut se lier avec des éléments légèrement plus électropositifs que lui (comme H et C) il prendra la première config et sera donc -2
s'il se lie avec des éléments plus électronégatifs comme l'oxygène ou les premiers halogènes (F, Cl, Br..) alors il pourra engager 2, 4 ou 6 liaisons, il sera dans des états +2, +4 ou +6.
voila voila
aller, fais la même chose avec le phosphore ...


ok.Je l'ai appris...
Bon tu peux voir ça en considérant la structure électronique du soufre :
dans le schéma joint j'ai mis les trois config électroniques possibles pour le soufre
Dans la première config on a 2 électrons célibataires donc 2 liaisons possibles.
Dans la deuxième 4
et dans la dernière 6
Le soufre peut se lier avec des éléments légèrement plus électropositifs que lui (comme H et C) il prendra la première config et sera donc -2
s'il se lie avec des éléments plus électronégatifs comme l'oxygène ou les premiers halogènes (F, Cl, Br..) alors il pourra engager 2, 4 ou 6 liaisons, il sera dans des états +2, +4 ou +6.
voila voila
aller, fais la même chose avec le phosphore ...
Pièce jointe 33256
Mais c'est quoi les valences alors ?
tu va me dire que je suis un peu chiant mais je comprends pas tes +2 ; +4 ; +6
Ex: Chlore (Z= 17): 1s² 2s² 2p(6) 3s² 3p(5)



Et bien c'est le nombre de liaisons (mis en commun de 2 électrons) que l'élément peut engager
on compte -1 si c'est avec un élément plus électropositif (on considère que l'élement "gagne" un électron) et +1 si c'est avec un élément plus électronégatif (on considère alors que l'élement "perd" un électron)


Tu serai me le faire en schema comme moi ?Et bien c'est le nombre de liaisons (mis en commun de 2 électrons) que l'élément peut engager
on compte -1 si c'est avec un élément plus électropositif (on considère que l'élement "gagne" un électron) et +1 si c'est avec un élément plus électronégatif (on considère alors que l'élement "perd" un électron)
stp




dsl j'ai pas vu le lien
dsl merci philou21
Donc premier colone est en 3s la suivante 3p et la dernier en 3d ? bien çà?
la valence du premier tableau est v=1.
la valence du deuxieme tableau est v=2.
la valence du troisieme tableau est v=4.
la valence du quatrieme tableau est v=6.
pour çà que tu as => +2, +4 ou +6.
j'ai bien comprit ?
mais une question logiquement c'est pas 3s puis 3p et 4s et enfin 3d ? donc on peut sauter l'ordre de remplissage ?

J'aimerais apporter quand même une petite précision :
-2, 0, 2, 4 et 6 ce sont les degrés d'oxydation du soufre.
Les valences sont 0, 2, 4 et 6.
La valence est le nombre de liaisons que l'élément peut former, que ces liaisons soient polariéses dans un sens ou dans l'autre ne change rien, donc la valence est positive.
P.S. ne pas confondre avec l'hapticité qui est le nombre d'atomes avec qui est lié l'atome considéré


Merci Paul, tu as raison de rectifier. Que ce soit +2 ou -2 c'est une valence 2.J'aimerais apporter quand même une petite précision :
-2, 0, 2, 4 et 6 ce sont les degrés d'oxydation du soufre.
Les valences sont 0, 2, 4 et 6.
La valence est le nombre de liaisons que l'élément peut former, que ces liaisons soient polariéses dans un sens ou dans l'autre ne change rien, donc la valence est positive.
P.S. ne pas confondre avec l'hapticité qui est le nombre d'atomes avec qui est lié l'atome considéré
cordialement


Par contre je pense que tu veux parler d'indice de coordination, l'hapticité ayant, je pense, une autre signification :
"Aptitude d'un ligand comportant 2 ou plusieurs atomes consécutifs reliés par un système d'électrons π à s'attacher globalement, par une seule liaison impliquant les électrons π délocalisés, à l'atome central d'une entité de coordination"


Donc si j'ai bien comprit:Par contre je pense que tu veux parler d'indice de coordination, l'hapticité ayant, je pense, une autre signification :
"Aptitude d'un ligand comportant 2 ou plusieurs atomes consécutifs reliés par un système d'électrons π à s'attacher globalement, par une seule liaison impliquant les électrons π délocalisés, à l'atome central d'une entité de coordination"
Etat fondamental du souffre:
merci d'avance

et là c'est moi qui suis un peu à coté. Merci d'avoir corrigéPar contre je pense que tu veux parler d'indice de coordination, l'hapticité ayant, je pense, une autre signification :
"Aptitude d'un ligand comportant 2 ou plusieurs atomes consécutifs reliés par un système d'électrons π à s'attacher globalement, par une seule liaison impliquant les électrons π délocalisés, à l'atome central d'une entité de coordination"





à y repenser d'ailleurs, la valence 0 pour le soufre me paraît abusée. Le soufre pur est à l'état S8, pas S. Donc degré d'oxydation zéro mais valence 2 dans ce cas





Dans le premier cas tu as deux électrons célibataires, donc on peut former 2 liaisons avec. Dans le deuxième cas tu as 4 électrons célibataires, donc 4 liaisons et c'est 6 pour le dernier.
Attention à ne pas confondre avec le degré d'oxydation. Il pourra être -II, 0 ou +II dans le premier cas par exemple.
m@ch3
Never feed the troll after midnight!


Donc,Dans le premier cas tu as deux électrons célibataires, donc on peut former 2 liaisons avec. Dans le deuxième cas tu as 4 électrons célibataires, donc 4 liaisons et c'est 6 pour le dernier.
Attention à ne pas confondre avec le degré d'oxydation. Il pourra être -II, 0 ou +II dans le premier cas par exemple.
m@ch3
ce serai comme ceci:


