Coucou !!!
Bon voila j'ai un ptit DM d'orga et je bloque sur un effet mesomere...voila on me demande de determiner l'effet mesomere du toluene or je ne trouve pas de forme mesomere et donc je n'arrive pas a savoir s'il est + ou - M si quelqu'un pouvait m'eclairer sur la question en m'expliquant ça m'interesse, je ne veux pas qu'on me dise +M ou -M mais comment on le trouve...
Merci bcp!!!!!
-----









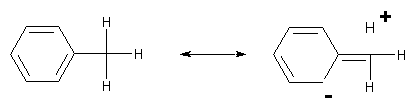
 en croyant voir la liaison C-C coupée, avec CH3- et Ph+.
en croyant voir la liaison C-C coupée, avec CH3- et Ph+.