Bonjour à tous!
J'espère qu'il y a un de vous qui pourra m'aider. J'ai seulement une question pour vérifier si mon raisonnement est bon.
Donc voilà, dans une optique de la théorie des orbitales moléculaires (remplissage des niveaux électroniques selon des schémas donnés), j'ai un problème qui me demande de donner les configurations électroniques, les ordres de liaison et celle qui a la plus grande énergie de liaison entre deux molécules, soit:
CN et CN-
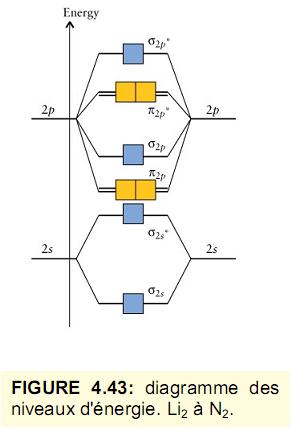
En assumant que le diagramme des niveaux d'énergie des orbitales moléculaires est celui des molécules homonucléaires diatomiques pour Li2 à N2, donné en pièce jointe ici.
Donc voici mon raisonnement(σ = sigma π=pi)
Les configurations énergétiques:
CN: σ2s2 σ2s*2 π2p4 σ2p1
CN-: σ2s2 σ2s*2 π2p4 σ2p2
Ensuite, l'ordre de liaison:
CN : 1/2 * (7é dans des orbitales liantes - 2é dans des orbitales non-liantes) = 2,5
CN-: 1/2 * (8é dans des orbitales liantes - 2é dans des orbitales non-liantes) = 3
Voilà, ensuite je fais comme déduction:
Le CN- aura donc une plus grande énergie de liaison puisqu'il a plus d'électrons contenues dans des orbitales liante.
Que pensez-vous de ma déduction? Ai-je raison de dire qu'il aura une plus grande énergie de liaison?
Et pour le CO et le CO-?
C'est pratiquement le même problème, avec comme différence que je dis que le CO aura une plus grande énergie de liaison car le CO- aura un électron de plus dans une orbitale non-liante. Suis-je dans le tord?
CO: σ2s2 σ2s*2 π2p4 σ2p1
CO-: σ2s2 σ2s*2 π2p4 σ2p2 π2p*1
Alors, vous en pensez quoi?
Merci d'avance
Maxime
Schéma des orbitales moléculaires:
-----






