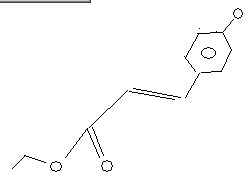
bonsoir
dans cette molecule
Lorsqu'on ajoute H20/H+,sur quels oxygenes vont allez H+ et OH-?je voudrais surtout savoir pourquoi?Quel O va etre attaqué et pourquoi?
Moi j'aurais dit que le O du carbonyle capte le H+ mais apparemment c'est pas ca...
MERCI!!!!
-----