Bonjour,
J ai vraiment besoin d aide pour un exercice que je n arrive pas a resoudre:
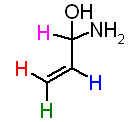
il s 'agit de déterminer le spectre rmn theorique d une substance exemple:
.............H2C=CH-CH-OH
...........................|
...........................NH2
Alors ce que le prof attend de nous c est de tracer une droite ou a gauche j ai la valeur de 10 qui decroit jusque a 0 ( la valeur la plus a droite)
Ces valeurs sont des valeurs ppm.
Et donc sur cette droite je represent les groupements comme -OH -NH2 etc avec leurs valeurs de ppm que je trouve dans un tableau jusqu a la pas de probleme mais apres je dois representer les pic de chaque groupement et c est la que je ne comprend plus rien parceque ces pics sont représenté sous forme de trait. Ces pics sont produits par les protons des differents groupements il me semble bref.
normalement mais c est pas clair du tout pour trouver ces pics il y a deux formules la premiere c est :a H équivalent ==> n+1
la deuxime c est : a H non équivalent ===>2n
alors a ce point j ' ai deux problemes : 1) comment savoir quand un H est equivalent ou non dans mon exemple .
2) comment connaitre le nombre de pic qui n ont pas de C ex: SH ou NH2.
Voila je sais que ma question est assé difficile mais j aurais besoin d une reponse car l exam approche et personne n a compris parceque notre professeur est un incapable et que ca change en fonction de son humeur du jour.
Merci vraiment beaucoup a celui qui peut m aider.
-----