Bonjour, j'ai du mal a prédire l'hybridation des molécules par exemple pour la molécule CO2 j'ai comme réponse que c'est une hybridation sp. Je comprend pas pourquoiC a une configuration 1s2 2s2 2p2 avec une hybridation sp elle aura 2 orbitales hybrides d'énergie inférieure au 2 orbitales p restantes, c'est orbitales seront déjà saturée donc une liaison avec O n'est pas possible. Quelqu'un connaitrais une règle générale qui peut prédire l'hybridation d'une molécule ??? parce que la je m'en sors pas

-----





 je vais essayer d'autres exercices maintenant.
je vais essayer d'autres exercices maintenant.
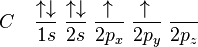
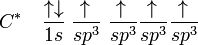

 Merci pour tes explications
Merci pour tes explications 