Bonjour,
Je voudrais un renseignement sur une question de vocabulaire :
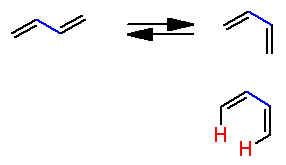
le butadiène possède deux "versions" : cis et trans, et on ne peut pas passer de l'une à l'autre. Je voudrais savoir s'il s'agit d'une différence de configuration ou de conformation.
En effet, comme il ne s'agit que de la rotation autour d'une liaison simple, j'aurais tendance à dire conformation, mais comme il faut casser la molécule pour opérer la-dite rotation, on rejoin la définition des isomères de configuration.
(oui, je sais, je me prends la tête pour pas grand chose, mais je voudrais éviter d'écrire des bétises sur ce que je vais projeter à mon jury d'oral).
Merci !
-----