Bonjour,
Si j'ai bien compris, le principe d'une pile de VOLTA est le suivant (répété plusieurs fois en série ) :
La fem de cette pile dépend-elle notamment du potentiel du couple Cu2+/Cu ??
Si la réponse est oui, je trouve ça bizarre vu que que la réduction "Cu2+ + 2e- donne Cu" ne se produit pas !?
-----




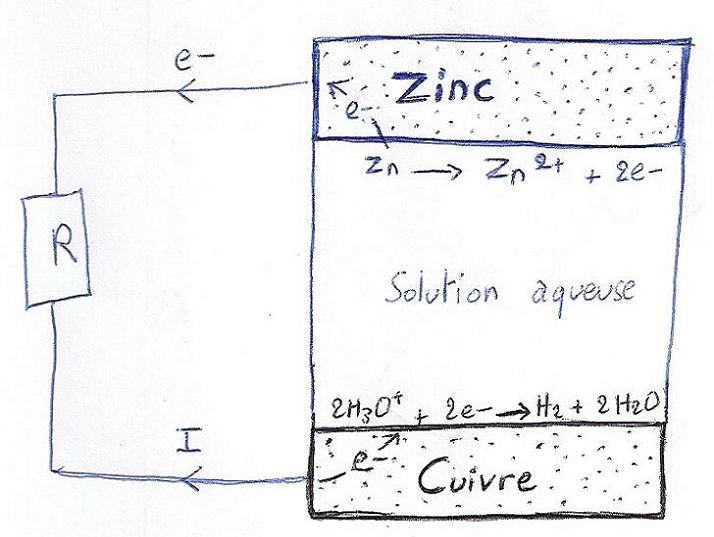




 : Pourquoi est-ce qu'un flux d'ions est nécessaire dans l'électrolyte pour que la pile débite un courant? Le courant électrique est établi à partir des électrons fournis par le Zinc et ils sont réceptionnés par les molécules d'H2O au niveau de la cathode à travers la charge électrique, donc pourquoi est-ce que ce flux d'ions est nécessaire ?
: Pourquoi est-ce qu'un flux d'ions est nécessaire dans l'électrolyte pour que la pile débite un courant? Le courant électrique est établi à partir des électrons fournis par le Zinc et ils sont réceptionnés par les molécules d'H2O au niveau de la cathode à travers la charge électrique, donc pourquoi est-ce que ce flux d'ions est nécessaire ?