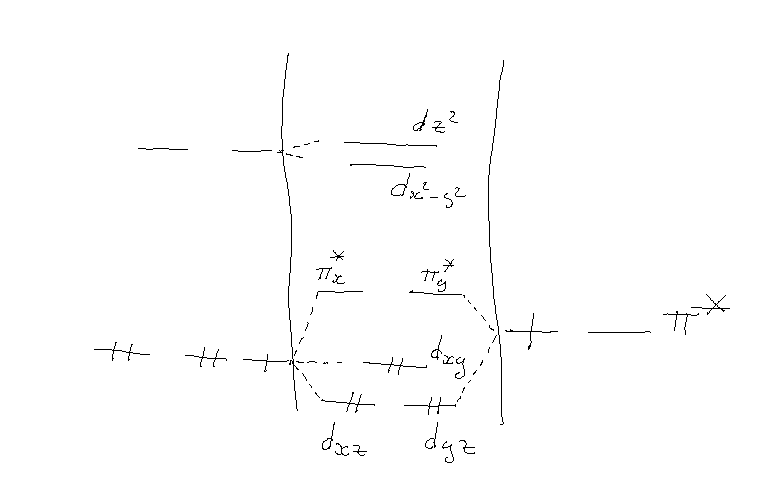
Bonjour , je suis actuellement sur l'élaboration d'un complexe d'osmium notamment (PPh4)2[Os(III)(NO)Cl5] . Celui-ci se révèle diamagnétique du à un champ magnétique relativement faible.. Ma question est comment justifier qu'il es bien diamagnétique et quel est la conséquence vis à vis de l'osmium? ( intéraction entre Os et NO? spin?)
Merci d'avance
-----