Tout d'abord bonjour, ou bonsoir pour certain !
Durant un cours de biochimie j'ai rencontré quelques soucis de concentration et n'a pas vraiment suivi le cours ! Il y a quelque chose que je ne comprend pas du tout : les orbitales moléculaires ! Ca me dépasse complètement !
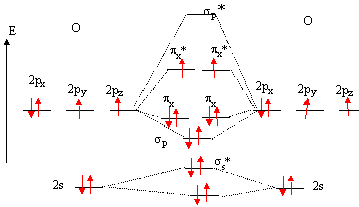
Tout d'abord je ne comprend pas comment savoir si une liaison px et pz forment une liaison σ ou π ? Doit on se représenter la molécule dans l'espace ? Si oui j'en deduis que si deux atomes sont alignés sur l'axe des x on aura une liaison σ entre les deux orbitales px des 2 atomes non ? Et donc 2 liaisons π entre les pz et py ?
(Si ce n'est pas ça il va falloir bien m'expliquer parce que même en ayant parcouru une dizaine de site je ne comprend toujours pas :/ je suis assez têtu)Et ensuite j'ai vu sur un diaporama sur internet qu'il y avait 8 orbitales atomiques sur un atomes de diazote (on compte 2 fois la couche 2s2 et 2 fois la couche 2px, 2pz, 2py du fait ded eux atomes d'azote ?)Et si quelqu'un pouvait également m'expliquer comment connaitre l'ordre des liaisons dans un diagramme energetique d'orbitales moléculaire ? (par exemple pourquoi dans le diagramme du dioxygène l'on a des liaisons π entre 2 σ ?Voilà je sais que celà fait beaucoup de question mais j'aimerai connaître la réponse pour aborder la suite du programme !Egalement pourquoi dans ce même exemple sur la liaison π non liante il n'y a que 1 électron mis en jeu pour chaque atome et non 0 comme dans la liaisons σ ?
Je remercie a l'avance ceux qui essayeront de m'éclairer !
-----






 ix* ^1 / piy* ^1
ix* ^1 / piy* ^1