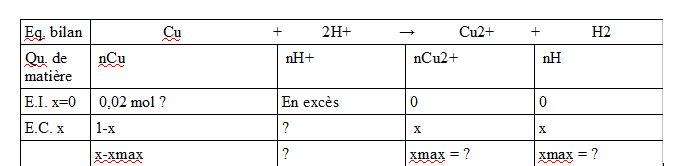Bonjour,
Je suis en première S et j'ai eu un DS de chimie la semaine dernière, je dois faire la correction pour lundi mais je bloque pour 3 exercices,
Voici les énnoncés :
Un morceau de cuivre Cu de masse m=1.5g est introduit dans 50mL d'une solution contenant des ions H+. Le morceau de cuivre disparaît totalement pour donner des ions Cu2+ et il se dégage du hihydrogène.
Données :
- Ecrire l'équation bilan correspondant à cette réaction
- Construire le tableau d'avancement relatif à cette réaction (Aide : les ions H+ sont en excès)
- Déterminer le volume de dihydrogène formé
- Calculer la concentration en ions Cu2+ en fin de réaction
- M(Cu) = 63.5 g/mol
- M(H) = 1 g/mol
- Constante gaz parfait R = 8.314 S.I.
Pour le 1. je trouve Cu + 2H+ -----> Cu2+ + H2 qui est juste
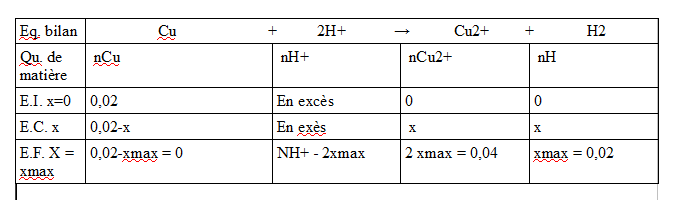
pour le 2. voir la pièce jointe (j'ai oublier de nommer la derniere ligne E.F. xmax)
Pour x max j'obtient 1 donc il ne resterait ni Cu ni H+ (puisqu'on multiplie x max par 2) donc les ions H+ ne sont pas en excès comme indiqué par le professeur
Pour le 3 je n'ai pas trouver comment faire
et le 4 j'ai fait
n = m/M
n = 1.45 / 63.5 = 2.2845 * 10^-2 mol ==> apparament la masse n'est pas 1.45 donc je ne sais pas comment la trouver
puis C = n/V
C = 2.2845 * 10^-2 / 5*10^-2 = 4.5669*10^-1 mol/L
Quelqu'un pourrait-il m'expliquer ces 3 exercices svp ?
Merci
Coline.
-----