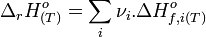Bonjour, voila je suis partiellement bloqué sur un exercice :
On considère la réaction d’oxydation du métal plomb par le dioxygène qui fournit l’oxyde de plomb (II) PbO
1. Ecrire l' equation de la réaction avec les nobres stoechiométriques entiers les plus petits possibles .
2Pb(s) + O2(g) = 2PbO(s)
2.A la température T0=298K le plomb et son oxyde sont solides et l' enthalpie standard de cette réaction est ΔrH°= -443.4 kJ mol^-1.
Exprimer ΔrH° en fonction de T en supposant qu' il ny ait aucun changement d'état.
J ai trouve ΔrH°=12T-446976 Jmol^-1
3. le plomb fond a 327° et ΔfusH°= 5.1 kJmol^-1. Donner l' expression de ΔrH°(T) pour T>Tfus.
La je bloque.
donnees : Cp°(Pb(s))= 27 Cp°(Pb(l))= 29 Cp°(O2(g))=32 Cp°(PbO(s))= 49
Merci d avance .
-----