Bonsoir,
Étant en première année de médecine (que j'ai raté en tant que primant) je profite donc des vacances pour réviser et arriver avec de l'avance sur mes concurrents pour le concours de l'année prochaine !!
En ce moment je bosse là chimie et en fait j'en suis aux orbitales moléculaires... pas très évident...
Bon pour récapituler:
- Les orbitales atomiques: c'est fait.
- Les notions d'orbitales moléculaires: c'est fait.
- Les molécules diatomiques: c'est fait (juste pour H2, H2+, He2 et He2+).
- Les orbitales Sigma 1S: c'est fait.
- Les orbitales Sigma étoile 1S: c'est fait.
- Les diagrammes énergétiques: c'est fait.
- Les hétérodinucléaires (exemple HF) avec le recouvrement axial entre 2py(F) et 1sH en phase et en opposition de phase c'est fait.
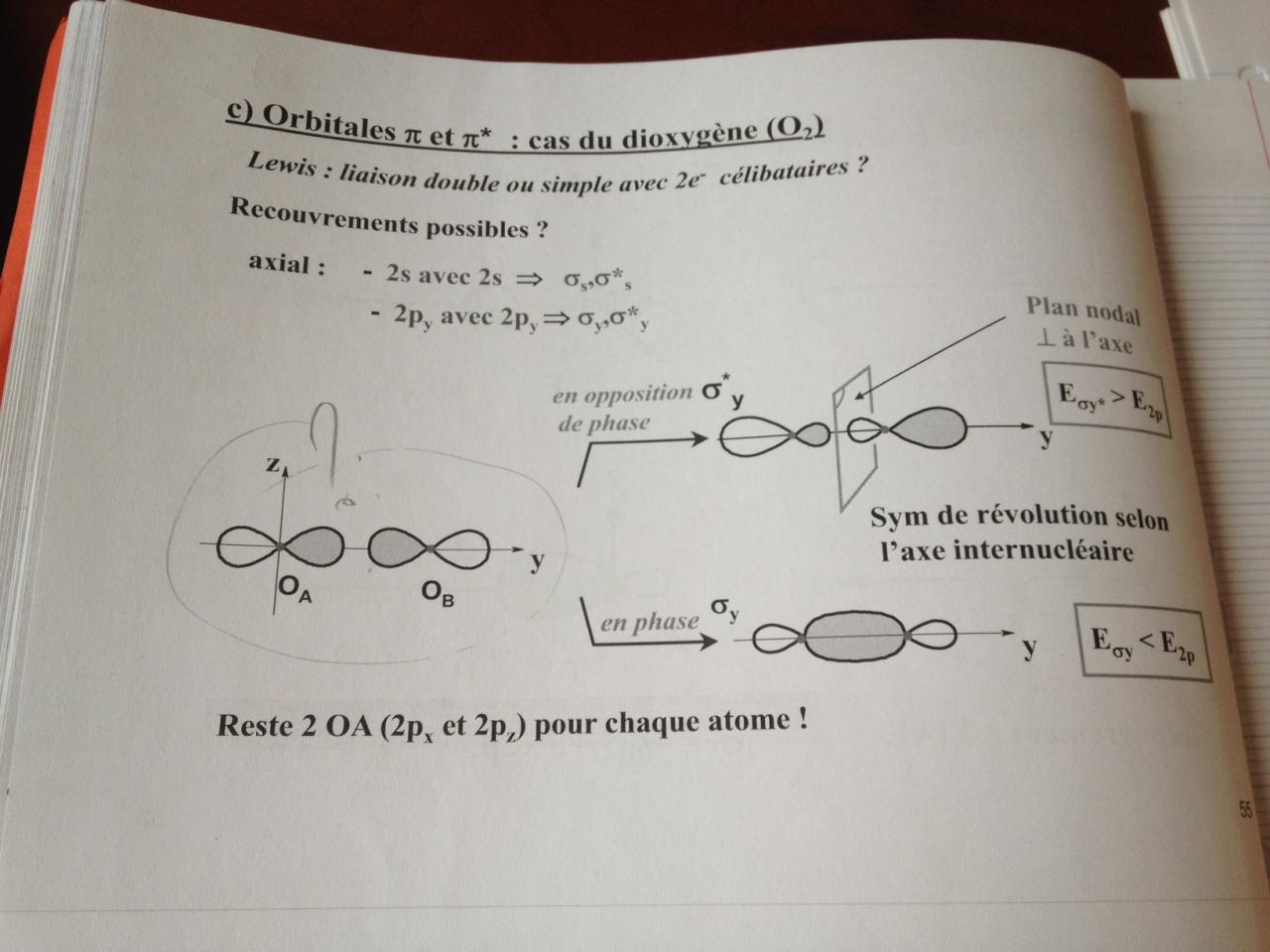
Voilà désormais j'en suis aux orbitales Pi et Pi étoile: cas du dioxygène (O2) et là j'avoue ne pas comprendre.
En fait pour OA je n'ai pas de problème on est en 2Py donc normal que le lobe de droit soit colorié mais pour OB je ne comprend pas pourquoi c'est le lobe de gauche qui est colorié et non celui de droite.
Pour passer en phase pas de soucis par contre je ne comprends pas non plus comment on passe en opposition de phase...
Concernant les Energie pas de soucis là dessus c'est du cour pur et bête !!
Voilà je vous remercie d'avance pour votre réponse !!!!
Bonne soirée à vous !
Franck
-----