Bonjour,
Je suis en train de m'exercer sur des exercices de Chimie mais voilà que je bloque sur un énoncé.
J'ai écrit la configuration électronique du Potassium qui est 1s2 2s2 2p6 3s2 3p6 4s1
4s1 représente, si je ne me trompe pas, les électrons de valence. Je veux maintenant calculer la charge effective ressentie par les électrons de valences de l'atome de Potassium. Je suppose qu'il faut s'aider du modèle de Slater mais je m'embrouille je vois pas vraiment comment m'y prendre !
Merci d'avance.
-----



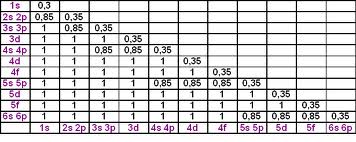





 , j'essaie de m'en sortir grâce aux livres et au net !
, j'essaie de m'en sortir grâce aux livres et au net !