Bonsoir. Je suis en train de préparer un TD - activité pour des élèves de 1ères S sur la cohésion des solides, et je me pose une question...
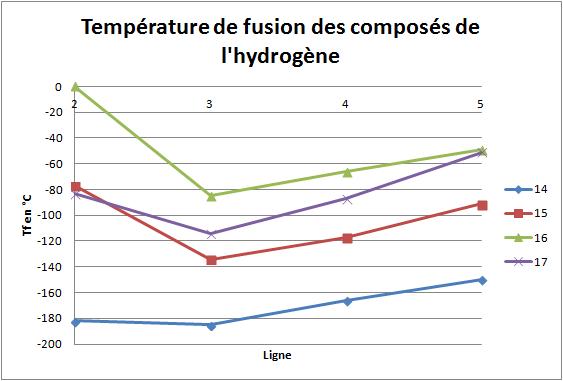
Les éléments des lignes 2, 3, 4 et 5 des colonnes 14 (C etc.), 15 (N etc.), 16 (O etc., chalcogènes) et 17 (halogènes) de la classification périodique forment des composés avec l'hydrogène. Si on considère les températures de fusion de ces composés, on observe plusieurs choses plus ou moins faciles à expliquer... Mais il en est une pour laquelle je ne parviens pas à trouver une explication satisfaisante.
Dans chaque colonne, les températures de fusion varient linéairement pour les composés de l’hydrogène des éléments des lignes 3, 4 et 5. Par contre, les composés de l'hydrogène des éléments de la ligne 2 ont tous une température de fusion plus élevée que ce qu'on pourrait calculer en faisant une régression linéaire à partir des composés de l'hydrogène des autres de la même colonne. On le voit sur le graphique ci-dessous :
Pour les colonnes 15, 16 et 17, la raison en est évidente : ces composés (NH3, H2O, HF) forment des liaisons hydrogènes, assez fortes car les éléments N, O et F sont franchement électronégatifs. Mais ce n'est pas le cas pour la colonne 14 : CH4 ne forme évidemment pas de liaisons hydrogènes, ne serait-ce que parce que le carbone ne porte pas de doublet non liant. Cependant, sa température de fusion est quand même un peu plus élevée que ce qu'on pourrait prévoir...
Ma question est donc : pourquoi la température de fusion du méthane est-elle si élevée ? Pourquoi CH4 fond-il à une température légèrement plus élevée que SiH4 ?
J'ai bien une piste pour donner une explication, mais c'est partiel... La cohérence du méthane solide est due aux forces de van der Waals, et précisément dans ce cas aux interactions entre dipôles instantanés (le méthane n'a pas de moment dipolaire permanent). Mais pourquoi ces forces de van der Waals sont plus grandes dans le cas du méthane que du silane ? je sèche...
-----