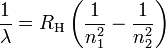Bonjour à tous,
voilà mon petit soucis, je suis un peu perdu concernant cette matière. J'aurais deux questions à poser.
La première concerne la relation de Rydberg, voici la formule que j'ai notée : µ = -Rh / h (1/n1² - 1/n2²) ou je trouve souvent celle-ci :
Pouvez-vous me dire si c'est la même chose ou si j'ai mal pris note.
De plus, pour la partie entre parenthèse, est-ce bien 1/n1² - 1/n2² ou 1/n2² - 1/n1² en fixant que n1 est l'énergie absorbée par un atome et n2 la libération de cette énergie sous forme lumineuse ?
Merci de votre réponse
-----