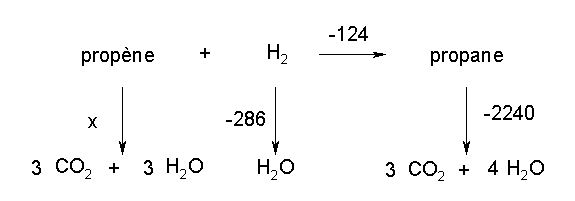
Bonjour je suis entrain de réviser pour ma seconde ses et je bloque un peu sur cette exercice.:
EXAMEN : L’enthalpie d’hydrogénation du propène en propane dans les conditions standards a
une valeur de -124 kJ/mole. La réaction est la suivante : CH2=CH-CH3(g) + H2(g) => CH3-CH2-CH3(g)
L’enthalpie standard de la réaction de combustion du propane vaut -2240 kJ/mole et la chaleur
de formation de l’eau H°f
H2O(l) = - 286 kJ/mole. Calculez l’enthalpie de la réaction de
combustion du propène. (Réponse : -2078 kJ/mole)
Si qqn pourrait m'aider ça serait super sympamerci d'avance!
-----