Salut la communauté.
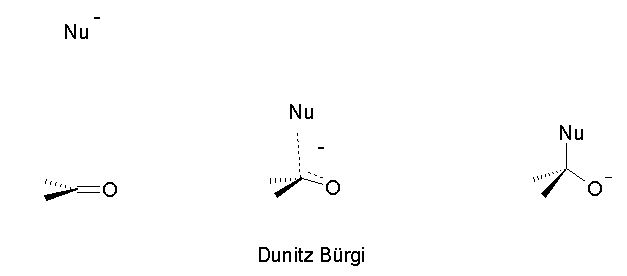
Dans un livre de biochimie, au chapitre des dérivés carbonylés, tout avait commencé pour le mieux j’avançais surement puis j'ai lu cette phrase : "L'addition correspond au remplissage par le doublet d'électrons du nucléophile de l'orbitale antiliante du groupement C=O".
J'essaye de comprendre, ici on définit une addition. On nous parle de l'orbital antiliante donc de configuration électronique puisqu'il s'agit de C=O alors c'est une hybridation, le carbone est hybridé sp2.
Déjà j'espère que mes remarques sont juste mais c'est tout ce que je peux en dire, je serais incapable de représenter les cases quantiques, c'est pas faute d'avoir cherché. D'après mes recherches :
1) Le carbone est excité : C* avec les orbitale 2p tel que : 2ps : | 2px : | 2py : | 2pz : |
2) L'oxygène est 2s2 2p4.
Mais après je ne vois pas comment faire, je remercie ceux qui ont pris le temps de lire mon post et aussi ceux qui y répondront.
-----




 .
. .
.
