Bonjour!
J'ai une petite question simple. Qu'est-ce qu'une orbitale antiliante? Je n'arrive pas à me le conceptualiser.
Merci!
-----


Bonjour!
J'ai une petite question simple. Qu'est-ce qu'une orbitale antiliante? Je n'arrive pas à me le conceptualiser.
Merci!


Bonjour
Si tu veux que les électrons soient liants, il faut que la densité électronique soit globalement située entre les noyaux (les électrons, négatifs, servent ainsi de colle entre des deux noyaux positifs : distribution de charge de type + - +). Une orbitale antiliante conduit à une distribution électronique située globalement en dehors de l’espace situé entre les deux noyaux (distribution de type -++-) cette distribution sera donc répulsive.


Bonjour!
Merci Philou21 pour la réponse, mais je ne comprends pas plus! Si je ne me trompe pas, chaque liaison moléculaire est composée d'une orbitale liante et d'une orbitale antiliante... n'est-ce pas? Ou sont-ce seulement les liaisons pi des éléments hybridés sp2 et sp?
D'où viennent les électrons des orbitales antiliantes? Est-ce que ce sont un des électrons d'un doublet électronique? Ou deux électrons célibataires? Ou autre chose?!
Arrgh! Je suis perdu!

Prenons l'exemple d'un simple de la molécule d'H2.Bonjour!
Merci Philou21 pour la réponse, mais je ne comprends pas plus! Si je ne me trompe pas, chaque liaison moléculaire est composée d'une orbitale liante et d'une orbitale antiliante... n'est-ce pas? Ou sont-ce seulement les liaisons pi des éléments hybridés sp2 et sp?
D'où viennent les électrons des orbitales antiliantes? Est-ce que ce sont un des électrons d'un doublet électronique? Ou deux électrons célibataires? Ou autre chose?!
Arrgh! Je suis perdu!
.
A partir des orbitales atomiques 1s de chaque orbitale des atomes d'hydrogène on forme une orbitale moléculaire symétrique et une orbitale moléculaire antisymétrique.
.
Apres quoi on place les 2 électrons dans l'orbitale symétrique qui forment le doublet électronique et qui assure la cohésion de la molécule. Pour cette raison on parle d'orbitale liante. L'autre orbitale même occupée par 1 seul électron ne contribue pas à la cohésion. C'est pourquoi on l'appelle orbitale antiliante.
.
Nota: Ceci est un modèle très simple (modèle LCAO)de la molécule d'hydrogène, mais qui est très loin de la réalité.


Attention, il ne faut pas confondre liaisons et orbitales moléculaires. Je crois que ton problème vient de la. Quel est ton niveau ?
La notion l’orbitale moléculaire antiliante apparait naturellement quand on forme celles-ci par combinaisons linéaires des orbitales atomiques. Si on combine N orbitales atomiques on obtient N orbitales moléculaires.
Parmi ces orbitales moléculaires, certaines sont liantes d’autres non liantes et enfin d’autres sont antiliantes.
Si tu prends 2 OA tu fais deux orbitales moléculaire : une liante et une antiliante.
Si tu as deux électrons à mettre, ils se mettront sur la liante et tu auras une liaison. Si tu as 4 électrons à mettre tu en mettras 2 sur la liante et 2 sur l’antiliante : résultat : pas de liaison
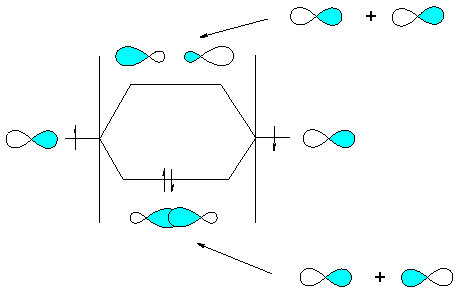


mariposa est ce que tu pourrais nous expliquer si le modele LCAO est trop simple comment tout cela se passe en réalité ? merci


Salut, non,l'orbitale définit la zone où sont les electrons, il faut faire le diagramme d'energie des orbitales et regarder où sont placés les electrons de la liaison, si les electrons sont dans la liante alors ils sont situés dans la zone de la liante et l'anti liante n'a qu'une existance potentiel (vu qu'ya pas d'electrons dedans) si un electrons a assez d'energie pour passer au niveau anti liant alors il definira la zone calculé pour l'anti liante.
Les orbitales representes la densités des electrons selon le niveau d'energie qu'ils ont, c'est pas la liaison qui est composé d'orbitales, ca veut rien dire ca.


Bonjour!Attention, il ne faut pas confondre liaisons et orbitales moléculaires. Je crois que ton problème vient de la. Quel est ton niveau ?
La notion l’orbitale moléculaire antiliante apparait naturellement quand on forme celles-ci par combinaisons linéaires des orbitales atomiques. Si on combine N orbitales atomiques on obtient N orbitales moléculaires.
Parmi ces orbitales moléculaires, certaines sont liantes d’autres non liantes et enfin d’autres sont antiliantes.
Si tu prends 2 OA tu fais deux orbitales moléculaire : une liante et une antiliante.
Si tu as deux électrons à mettre, ils se mettront sur la liante et tu auras une liaison. Si tu as 4 électrons à mettre tu en mettras 2 sur la liante et 2 sur l’antiliante : résultat : pas de liaison
Sur l'image que tu as envoyée, les orbitales blanches sont antiliantes et les bleues, liantes, c'est bien ça? Dans les orbitales bleues se trouvent les électrons et dans les blanches, qu'est-ce qu'il y a? Rien?
Qu'est-ce qu'une liaison chimique?
Je croyais qu'une liaison chimique résultait du couplage de deux orbitales atomiques, ce qui forme une orbitale moléculaire dans laquelle se trouvent les électrons que partagent les deux atomes liés, comme sur l'image. Les deux orbitales liantes qui se combinent forment une liaison, non?
Merci encore!
Salut!


Salut, non une liaison c'est la mise en commun d'electrons (dans le cas le plus simple).Je croyais qu'une liaison chimique résultait du couplage de deux orbitales atomiques, ce qui forme une orbitale moléculaire dans laquelle se trouvent les électrons que partagent les deux atomes liés, comme sur l'image. Les deux orbitales liantes qui se combinent forment une liaison, non?
Une orbitale ca n'existe pas, c'est une representation arbitraire pour estimer la zone de présence des electrons.
D'ailleurs il ya plusieurs façon de representer les orbitales, la classique que tu connais dejà c'est les orbitales localisés, c'est le plus utilisés en chimie organique car c'est la representation la plus intuitive..mais yen d'autres.


oui en parti mais là tu nous ramènes en quelque sorte au modèle de lewis en disant que une liaison résulte d'un partage d'e- mais par ex la molécule H2+ existe à partir d'un e- donc je partage assez le point de vu de Kopfschmerzen moi aussi. Sinon vous pourriez nous donner d'autre exemples de modélisation de la densité de présence des e- hors LCAO qui apparemment n'est pas la plus fidele a la realité ? merci


je pense que la quasi totalité des calculs actuels, sur les molécules, se font avec l'approximation LCAO.


Tout d'abord salut tout le monde,
Donc voilà je faisais cette confusion entre orbitale et liaison et donc maintenant c'est plus clair.
Seulement je me pose la question suivante:
Quand parle t'on de liaisons dans ce cas et comment se forment t'elles (dans le cas d'orbitales moléculaires sigma par exemple)?
PS: Je suis en 1ere année de licence en biologie.


J'ai jamais dis ca, j'ai dis que les electrons étaient partagés, ie: ils se repartissent entre les atomes, c'est le cas de H2+.oui en parti mais là tu nous ramènes en quelque sorte au modèle de lewis en disant que une liaison résulte d'un partage d'e- mais par ex la molécule H2+ existe à partir d'un e- donc je partage assez le point de vu de Kopfschmerzen moi aussi. Sinon vous pourriez nous donner d'autre exemples de modélisation de la densité de présence des e- hors LCAO qui apparemment n'est pas la plus fidele a la realité ? merci

