Bonsoir,
je ne suis pas sûr de bien comprendre quelque chose (sûrement très bête) dans la théorie du champ des ligands :
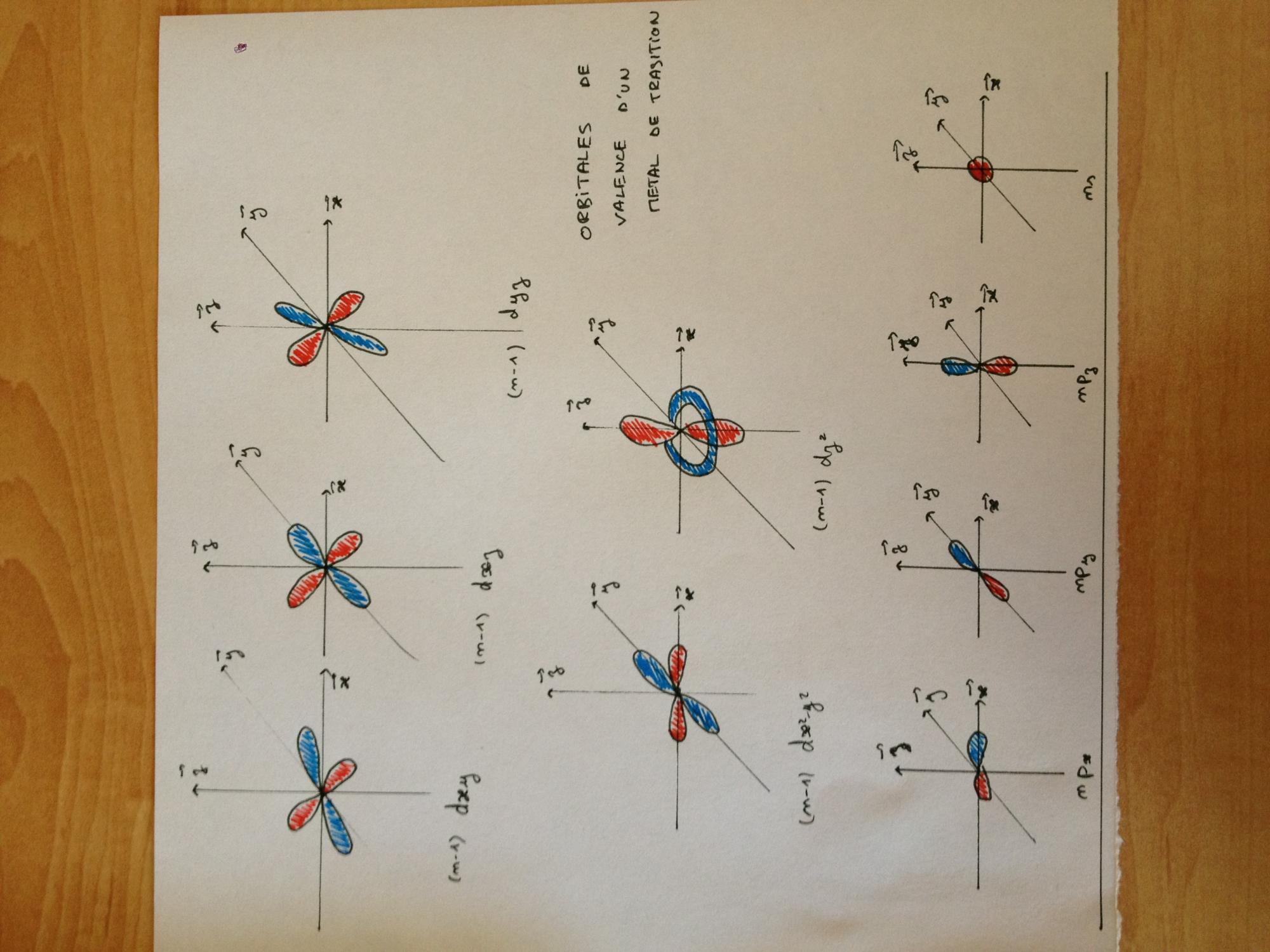
comme montré sur la 2ème image, le diagramme des OM montre l'implication de 1 OA s, 3 OA p et 2 OA d (dz2 et dx2-y2). Les 3 autres dry, dyz et dxz étant non-liantes, d'après le texte. Les 6 premières orbitales se combinent avec les 6 orbitales contenant les doublets non-liants des ligands, toujours d'après le texte. Les 3 orbitales non-liantes du métal n'aurait pas la bonne symétrie pour être liantes.
Donc, si je comprend bien, les OA s, p et dz2 et dx2-y2 ont la bonne symétrie pour se lier à une OA non-liante d'un ligand. "recouvrement entre 2 lobes d'orbitales", c'est ça ? Et les dry, dxx et dyz ne font pas ce recouvrement ? Pourtant dans une dxy par exemple il y a 4 lobes alors pourquoi le même recouvrement ne serait pas possible ?
Comme les 3 dernières orbitales sont non-liantes, elles sont remplies par des doublets non-liants qui participent à la rétrodonation, c'est ça ?
Merci d'avance
IMG_0042.jpgIMG_0043.jpg
-----