Bonjour,
Voila je suis tombée sur un exos qui me pose probleme:
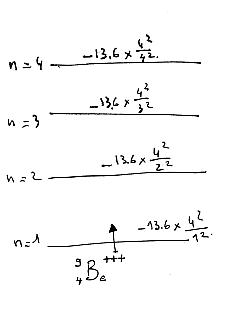
On considère l'ion Be4+ dans un état excité caractérisé par le nombre quantique n=4
Cet ion se désexcité en émettant une radiation
Quelle est en eV l'Emin que peut perdre l'ion? l'Emax?
Quelles sont les lambda max et mi des radiations émises ?
Je pense qu'il faut utiliser des formules suivantes mai sais pas vraiment comment faire
E=hv -> E=hc/lambda
E=-13,6Z^2/n^2
Merci d'avance
-----





 :'(
:'(