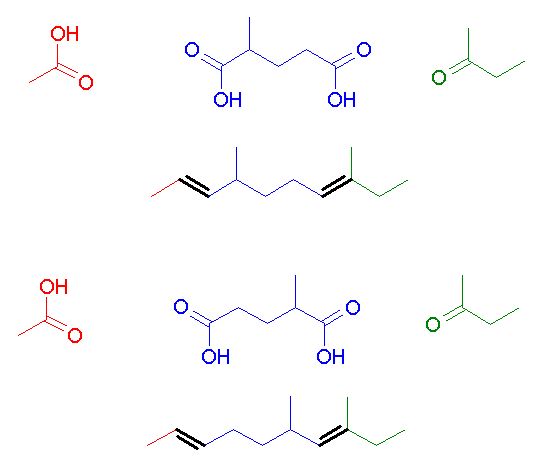
Bonjour je bloqu sur un exercice dont l'énoncé est:
L'ozonolise de la molécule A donne 3 dérivés carbonylés :
CH3-COOH HOOC-CH(CH3)-CH2-CH2-COOH CH3-CO-CH2-CH3
Quelle est la formule développé de A ?
quelqu'un pourrait-il me donner des indications ?
merci d'avance
-----