Bonsoir,1. Donner les unités SI des grandeurs mises en jeu dans la loi de Beer-Lambert .
Je débute en analyse spéctral et j'aurais besoin d'un peu d'aide pour comprendre la trame d'un exercice. On viens de commencer le chapitre, rien ne presse donc, mais je comprend pas très bien ce qu'il faut faire. Pouvez vous me guider ?
DONNES :
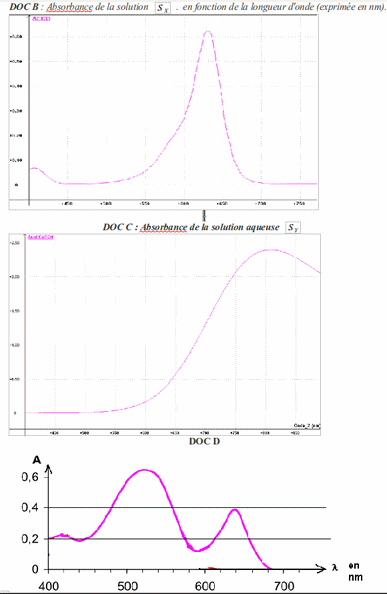
Les spectres B , C et D fournis ont été obtenus à l'aide de cuves dont la longueur traversée par la lumière est L=1,0 cm, et d'un appareil permettant de mesurer l'absorbance des solutions qui y sont disposées.
DOC A :
La loi de Beer-Lambert indique
A=E*l*c
Où A est l'absorbance
E : coefficient d'extinction molaire
l : épaisseur de la solution traversée.
c : concentration molaire.
2.a La solution est une solution d'une espèce ionique Y à 0,20 mol/L.
A l'aide du document C, déterminer l'absorption de la solution pour = 800 nm.
2.b Déterminer la valeur de l'extinction molaire de l'espèce Y.
3. De quelle couleur est la solution contenant l' espèce Y?
4. L'extinction molaire à 425 nm de l'espèce X est .
Cette espèce est vendue en solution concentrée.On dilue par 2000 un échantillon de cette solution commerciale pour obtenir la solution fille . Le document B est le spectre de la solution fille.
4.a A l'aide du document B, déterminer l'absorption de la solution fille pour = 425 nm.
4.b En déduire la valeur de la concentration molaire de la solution commerciale .
5. La solution dont le spectre d'absorption est donné en C , contient l'une des deux espèce colorée (X ou Y), laquelle?
6.Est-il raisonnable de faire l'hypothèse d'une autre espèce colorante dans la solution dont le spectre est le DOC C ? Citez une méthode (autre que spectroscopique) pour vérifier cette hypothèse
Cordialement,
-----