Bonjour !
Je prépare un Tp sur la cinétique et le problème c'est qu'on a pas encore eu de cours sur la cinétique chimique du second ordre.
La première partie du tp consistait à déterminer l'ordre de grandeur de la constante de vitesse k de la réaction et l'ordre global de la réaction.
Par contre, pour la deuxième partie j'ai un peu de mal. Pouvez vous m'aider s'il vous plaît ?
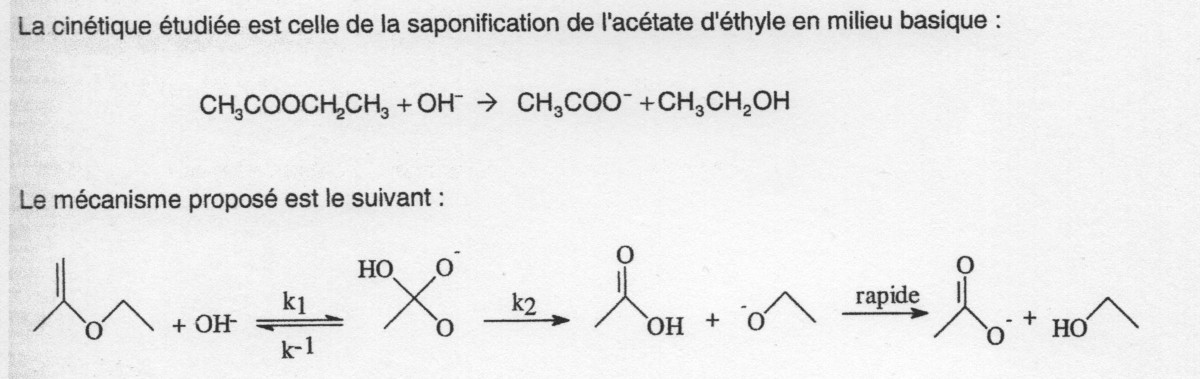
On travaille sur la réaction de saponification de l'acétate d'éthyle en milieu basique :
CH3CO2CH2CH3 + HO- = CH3COO- + CH3CH2OH
But : Vérifier les ordres partiels de cette réaction : on déterminera l'ordre de la réaction par rapport à l'ion hydroxyde.
Mode opératoire
On mets dans un bécher 50 mL de la solution d'acétate 0,4M et une sonde conductimétrique.
On y ajoute 5 mL de soude 0,4M à t=0.
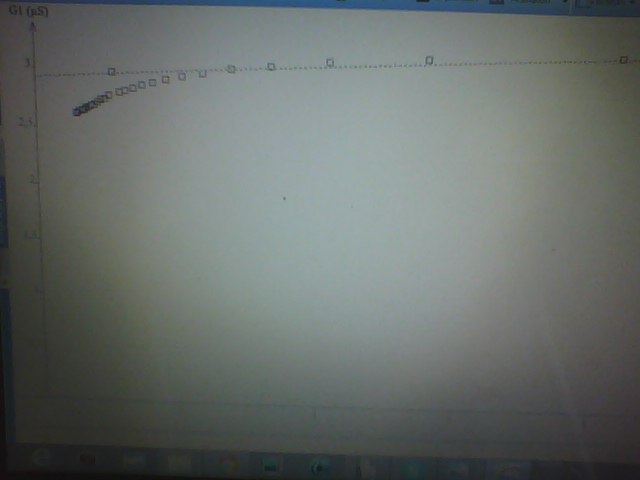
On relève la conductance en fonction du temps.
(1) Tracer ln(G-G∞) en fonction de t.
(2) A l'aide du graphe, établir le résultat demandé.
G(t) = σ(t)/K et σ(t) = λNaOH*([NaOH]-x) + λCH3COONa*x
G∞ = σ∞/K et σ∞ = λCH3COONa*[NaOH]initiale
Je ne sais pas quelle est la relation entre ln(G-G∞) et les ordres partiels.
-----