Voici la suite du DM
Exercice 3
On dissout un comprimé d'aspirine (notée AH dans la suite) de masse m=500 mg dans un volume V=100 mL d'eau distillée. La mesure du pH de la solution
obtenue donne pH = 2,6
1. Ecrire l'équation de la réaction acido-basique entre l'aspirine et l'eau.
C9H8O4(aq) + H2O(liq) = C9H7O4-(aq) + H3O+(aq)
2. Déterminer la concentration finale des ions oxonium H3O+ dans la solution.
[H3O+] = 10^ph = 10^-2,6 = 2,5 x 10^-3 mol.L-1
3. Déterminer la quantité de matière d'aspirine initiale contenue dans un comprimé, sachant que la masse molaire est M = 180 g.mol-1
n = m/M
n = 0,5/180
n= 2,7 x 10^-3 mol
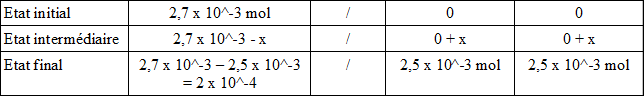
4. Dresser le tableau d'avancement de la réaction de l'aspirine avec l'eau.
5. Déterminer l'avancement final de la transformation.
voir tableau
6. Déterminer la concentration molaire de l'aspirine à l'équilibre.
c=n/v
c=2 x 10^-4/0,1
c= 2x10^-3 mol.L-1
-----