Bonjour (ou bonsoir) !
Je suis bloquée sur un exercice, que je n'arrive pas à résoudre malgré mes nombreuses tentatives:
Soit la réaction CO(g)+2H2(g)=CH3OH(g)
Question:
On définit le rendement r comme le rapport de la quantité de méthanol obtenue sur la quantité initiale de monoxyde de carbone.
En partant d'un mélange stoechiométrique de monoxyde de carbone et de dihydrogène, établir la relation entre r, K°, P (pression totale) et P°(P°=1 bar).
Mon début de raisonnement:
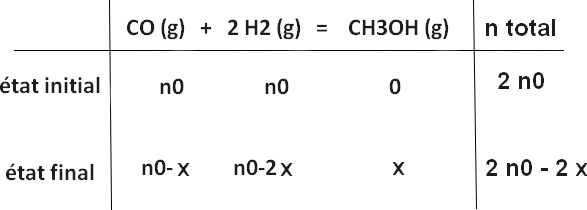
A partir de nCO=nH2=n0, on peut dresser le tableau d'avancement:
avec x = avancement (= ξ)
On a donc:
r=qté méthanol obtenue / qté CO initiale = x/n0
Les pressions partielles:
PCO= (n0-x)/(2n0-2x) P= (1/2)P
PH2= (n0-2x)/(2n0-2x) P= (1/2) ((n0-2x)/(n0-x)) P
PCH3OH= x/(2n0-2x) P= (1/2) (x/(n0-x)) P
J'ai ensuite injecté ces valeurs dans la constante d'équilibre K°:
K°= (PCH3OH/P°)/[(PCO/P°)(PH2/P°)2]
=[x/(n0-x)] / [(1/2)((n0-2x)/(n0-x))P]2
Puis à partir de là, je ne sais plus comment faire, en supposant que je m'y sois bien pris jusqu'ici...
Merci d'avance !
-----