Bonjour,
Dans le cadre d'une expérience que j'aimerais réaliser dans mon travail, il faudrait que je créer 1 solution d'un litre à pH2 et une solution d'une litre à pH 8.
Pour la solution acide, je pensais dissoudre de l'acide tartrique (en poudre) dans de l'eau. Mais mes cours de chimie sont un peu loins. Pourriez-vous s'il vous plait m'indiquer si je procède de la bonne façon ?
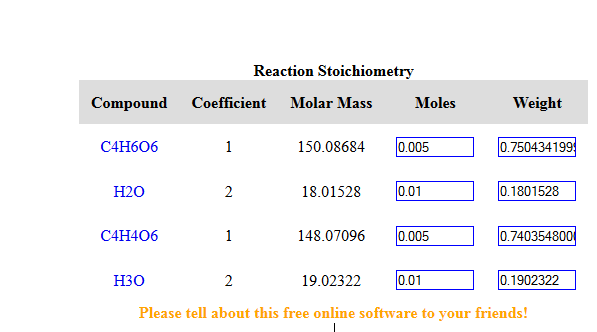
Formule brute: C4H6O6.
Masse molaire: 150.08g/mol
A l'equivalence on a C4H6O6 + 2H2O <==> C4H4O62- + 2H30+
[H3O+] = 10-pH
[H3O+] = 10-2
[H3O+] = 0.01mol/L
n =C.V
n = 0.01mol/L * 1L
n = 0.01 mol
Pour avoir 0.01mol de H30+, il faut 0.01/2 mol de C4H6O6 donc 0.005mol (cf eq)
Il faut donc peser: n * masse molaire = 0.005mol * 150.08g/mol = 0.75g d'acide tartrique.
C'est bien ça ? Merci !
Par hasard, auriez-vous une idée d'un acide en poudre qu'on trouve facilement qui nécessiterait de prélever une masse plus importante, prélevable avec une balance de cuisine (par ex: 10g) ?
Cordialement
-----