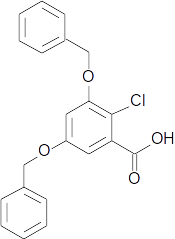
Bonjour,
Je m'efforce depuis deux jours (à coups de Vollhardt, entre autres recherches perso) à trouver quelles sont les deux réactions successives qui auront lieu sur la molécule suivante :
Molécule J.png attaquée par la soude en excès, puis le chlorure de benzyle en excès.
Dans le problème que je m'efforce de résoudre, il y a plusieurs réactions successives sur la molécule initiale (nommée "J"). Le tout est de savoir "quelle réaction va agir sur quelle groupe".
Le terme "excès" m'a fait penser que ces réactions avaient lieu sur les groupes hydroxyles de J.
Cela pourrait être une réaction de Williamson. En effet, ici, il me semble que le groupe OH peut devenir un groupe carboxylate, par stabilisation (mésomérie). Il est alors apte à subir une attaque par le chlorure de benzyle, sous forme de SN2. Il en résulte deux éthers sur le cycle benzénique de la molécule K. Comme ceci : molécule K.png
Sauf que cela ne me convient pas, car j'aboutis à une impasse pour la dernière réaction. Je ne sais donc pas si mon point de départ est bon : peut-être qu'une réaction de Williamson n'est pas possible. Dans ce cas, la soude agit sur l'acide carboxylique, ce qui a été mon idée première. Mais, ensuite, je ne vois pas bien ce que pourrait faire le chlorure de benzyle.
La réaction n°2 est l'attaque de K par LiH4, puis hydrolyse. Il s'agit alors d'une réduction par un hydrure.
J'opte alors pour une attaque du groupe carboxylique, devenant un groupe -OH. On obtient la molécule L.
La réaction n°3 est l'attaque de L par le chlorure de tosyle dans le pyridine. Elle se ferait sous forme de substitution du groupe OH précédent par un groupe tosylate (toujours, d'après moi). On obtient M.
La réaction n°4 se fait par réaction de M avec le triphénylephosphine (Ph3P), puis par réaction avec le n-butyllithium. Pour Ph3P, je pense qu'il va se substituer au chlore, seul groupe n'ayant pas été attaqué (d'après moi...). Mais, ensuite, je ne vois pas en quoi le n-butyllithium peut agir : il n'y a pas d'hydrogène sur le carbone auquel est attaché le groupe PhP3.
Je vous ai livré ici le résultat de mes réflexions, sachant que j'ai d'autres pistes, très fragmentaires et encore moins encourageantes... (comme la transformation de tous les groupes en groupes alcool... pour obtenir au final à une bête molécule de benzène!)
De stimulant, ce problème en est devenu pénible et embrouillant
, tant j'en arrive à partir dans tous les sens.
Merci à ceux qui prendront le temps de lire ma prose et m'éclaireront de leurs lumières.
PS: Je précise que ce problème est issu d'un devoir pour préparer l'agrég int de physique-chimie.
-----