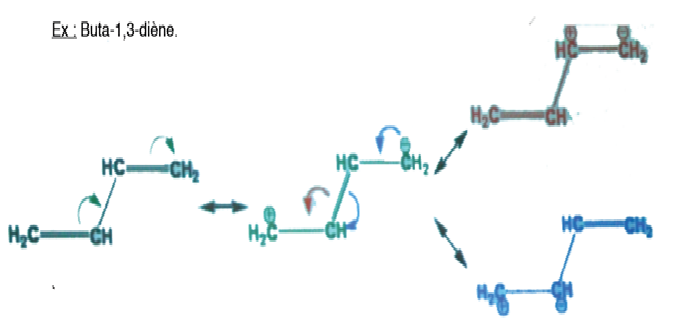
Salut !
Dans cette exemple, j'ai cru remarqué qu'on perd des électrons entre les deux formes raisonnantes ! La première forme a 3 liaisons sigma et deux liaisons pi. Alors que la deuxième n'a qu'une seule liaison pi donc il y a deux électrons en moins.
Pour compenser il faudrait deux carboanions (qui ont un électron en plus) mais on a un carbocation et un carboanion ce qui au final laisse toujours ces deux électrons perdus dans la nature ! Qu'en dite vous ? Je crois qu'il y a un truc que j'ai pas bien compris dans tout ça ^^.
-----