Bonjour, Après quelques recherches je n'ai pas trouvé les réponses à mes questions sur la distillation azéotropique c'est pourquoi je sollicite votre aide.
Prenons par exemple ce diagramme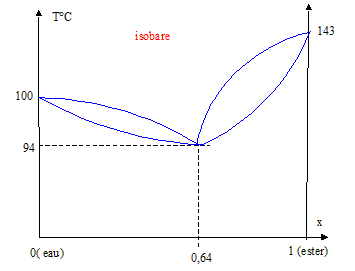
Si j'ai un mélange à x(ester)= 90% et que je le chauffe. Va-t-il bouillir à 94 °C ou plutôt vers 130°C?
D'ailleurs, je me demandais si le nombre de plateaux théoriques influait sur la température de la vapeur en tête de colonne, on aurait alors cette température différente de celle du liquide en ébullition?
Avec ces questions en tête, j'ai du mal à faire cet annale. Pouvez vous aussi m'aider sur ca?
Enoncé :
on se propose de distiller un mélange d’acétone (Teb 56,5 °C) et de cyclohexane (Teb 81°C) contenant 10 moles d’acétone (ou butan-2-one) et 90 moles de cyclohexane. Ces deux solvants forment un mélange azéotropique dont les points caractéristiques sont T azéotrope=36°C pour la température d’ébullition de l’azéotrope et x azéotrope= 0,4 pour la fraction molaire en acétone de l’azéotrope.
les questions qui me posent problème sont les suivantes :
Quelle est la fraction molaire en acétone de la première fraction recueillie ? A quelle température sort elle ?
Quelle est la fraction molaire en acétone de la dernière fraction recueillie ? A quelle température sort elle ?
Pour la 1ère est ce bien T azéotrope et x azéotrope?
Pour la seconde je dirais que la fraction molaire en acétone est de 0 car on distille du cyclohexane pur à 81°C
Merci d'avance pour votre aide
-----




 . Quand vous dites que la température augmente après que le mélange ai bouilli à 115°C, cette augmentation se fait-elle subitement ou petit à petit? Il me semblait que la température allait se stabiliser à 115°C jusqu'à ce qu'il ne reste plus d'eau dans le mélange initial...
. Quand vous dites que la température augmente après que le mélange ai bouilli à 115°C, cette augmentation se fait-elle subitement ou petit à petit? Il me semblait que la température allait se stabiliser à 115°C jusqu'à ce qu'il ne reste plus d'eau dans le mélange initial...