Bonjour,
Je ne comprends pas pourquoi l'Ozone a 2 structures limites et un hybride de résonance car pour moi l'hybride de résonance est la seule structure qu'il peut y avoir.
Dans les formes limites l'O central a pour charge formelle + 1 mais puisqu'un autre O a -1, c'est plus logique de créer une deuxième double liaison et tous les O aurait 0 pour charge formelle non ? Dans le sens que, pourquoi soit l'un ou soit l'autre donne un électron pour faire une double liaison avec l'O central alors que les 2 pourraient simplement le faire?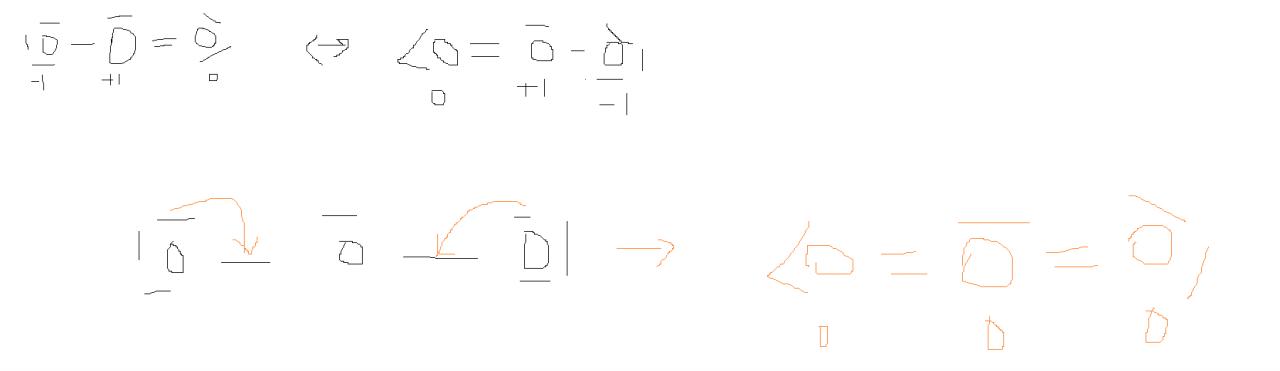
-----



