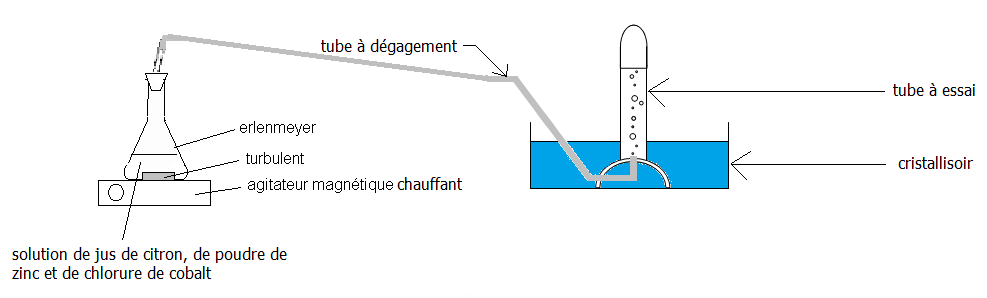
Bonjour à tous! Je travaille sur la réaction d'oxydoréduction zinc/ions H+ (le zinc étant le réducteur et H+ l'oxydant)
Zn(s) + 2H⁺(aq) → Zn²⁺(aq) + H2(g)
Je voudrais récupérer le gaz (le dihydrogène) produit. J'ai donc un montage classique pour récupérer un gaz avec un cristalloir rempli d'eau ect...
Le problème c'est que la réaction d'oxydoréduction est très lente: je chauffe donc la solution tout en l'agitant grâce à un agitateur magnétique chauffant. De plus j'ai pris de la poudre de zinc à la place des plaques auquel j'ai ajouter quelques milligrammes de chlorure de cobalt comme catalyseur.
Le problème c'est que je ne sais pas trop quel volume doit avoir ma solution d'ions H+ et quelle masse de poudre de zinc et quelle température pour un dégagement optimal (et je dois rédiger une fiche expérimentale donc c'est mieux si j'avais des valeurs) !
Pour l'instant j'ai tester avec 30°C et le volume de la solution ainsi que la masse de poudre de zinc au hasard
Avez vous des idées?
Et y a t-il un nom pour le montage?
-----