Bonsoir,
J'ai récemment eu un cours évoquant brièvement la mésomérie, et donc les formes limites de résonance, or il semblerait que quelques choses plus ou moins importantes m'échappent.
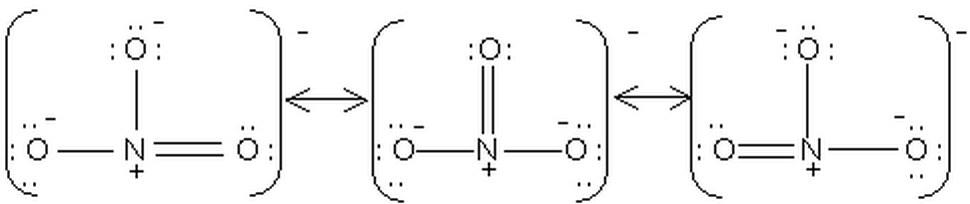
Prenons l'exemple de l'ion NO3-, il possède les 3 formes limites de résonance suivantes:
no3-1.png
Je ne comprends pas pourquoi, par exemple, cette forme ci n'est pas valable? Il y a le même nombre de doublets, la charge réelle de la molécule est conservée, alors qu'est-ce qui n'est pas respecté?
no3-2.png
D'avance merci pour vos réponses, je suis bloqué là dessus depuis un bon bout de temps.
-----