bonjour,
j'ai un exo a faire que je ne comprend vraiment pas .. j'ai beau chercher sur le net et dans les bouquins je bloque ..
si vous pouviez m'expliquer avec vos mots peut être que sa fera tilt ^^
Les molécules suivantes comportent-elles des systèmes conjugué ?
Dans le cas d'une réponse positive, dessiner toutes les formes limites ainsi que l'hybride de résonance et indiquer si un effet mésomère existe.
2-méthylprop-1-èn-1-ol
j'ai un doute il est conjugué ?
//\ une double puis une simple
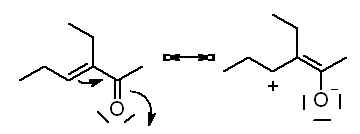
3-éthylhex-3èn-2-one
/\//\/ simple simple double simple simple donc non conjugué
hexa-1.4-diène
//\/\\/ double simple simple double simple dc non conjugué
hexa-2.4-diène
/\\/\\/ simple double simple double simple donc conjugué
si quelqu'un peut m'expliquer avec une molécule déjà que je comprenne ..
merci d'avance.
-----