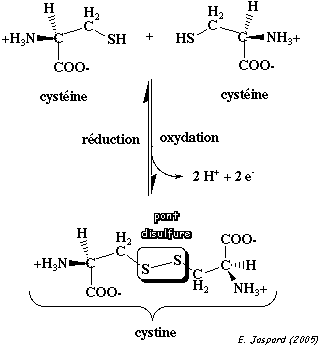
Bonjour, je suis actuellement en 1S et dans le cadre de mes TPE j'en suis venu à étudier une molécule particulière la kératine, qui est composée de cystine, qui est elle même un assemblage de 2 cystéines, mais avec de liaisons hydrogène en moins. Ce qui m'intéresse dans la molécule est la liaison disulfure. Un bon schéma vaut mieux qu'un long discours.
Je me demandais alors pourquoi un milieu basique favorisait la réduction de cette molécule? peut être car la molécule HO- capte les électrons des hydrogènes, puis après, le réducteur, par exemple le béta mercaptol, capte les 2 protons restants.
Si mon hypothèse est fausse (ce qui est fort probable) pourriez-vous m'expliquer comment la transformation des cystéines en cystines s'effectue, c'est à dire comment agit le réducteur ou éventuellement le pH, quelles liaisons se forment...
Je vous remercie de votre aide
-----




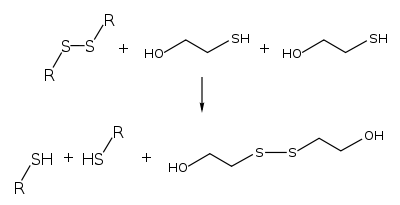

 . Un acide est une molécule capable de céder (facilement) un proton. Une base est une molécule ou un élément chimique capable de capter (facilement) un proton. Une molécule acide va donc céder un
. Un acide est une molécule capable de céder (facilement) un proton. Une base est une molécule ou un élément chimique capable de capter (facilement) un proton. Une molécule acide va donc céder un 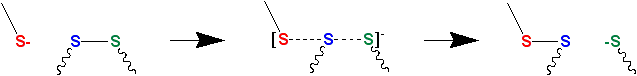 . Ainsi, il est nécessaire d'avoir au moins 2 molécules de bêta-mercaptoéthanol car la première va recréer un pont disulfure avec avec une cystéine, donc l'une des 2 cystéine sera "libre", puis la deuxième devra attendre une autre molécule de béta-mercaptoéthanol, qui se liera avec la première pour libérer l'autre molécule de cystéine. Si vous m'avez bien suivi, une question perdure encore: les 2 cystéines ont encore un groupement thiolate (S-), ce qui fait qu'elles se comportent comme les réducteurs (?), donc comment vont-elles regagner un proton pour former le groupe -SH (thiol) si le pH du milieu est basique. (A moins que ce soit juste le pH du réducteur qui soit basique et que le pH de la solution soit acide?)
. Ainsi, il est nécessaire d'avoir au moins 2 molécules de bêta-mercaptoéthanol car la première va recréer un pont disulfure avec avec une cystéine, donc l'une des 2 cystéine sera "libre", puis la deuxième devra attendre une autre molécule de béta-mercaptoéthanol, qui se liera avec la première pour libérer l'autre molécule de cystéine. Si vous m'avez bien suivi, une question perdure encore: les 2 cystéines ont encore un groupement thiolate (S-), ce qui fait qu'elles se comportent comme les réducteurs (?), donc comment vont-elles regagner un proton pour former le groupe -SH (thiol) si le pH du milieu est basique. (A moins que ce soit juste le pH du réducteur qui soit basique et que le pH de la solution soit acide?)