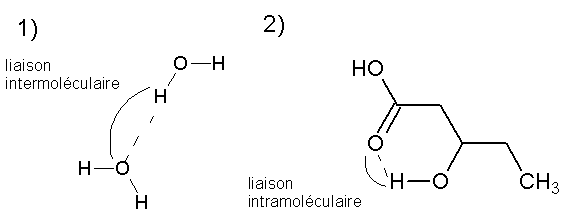
Bonjour tout le monde, j'ai une petite question concernant les LH inter et intra moléculaires.
Comment sait-on de quel type de LH il s'agit ? J'ai du mal à les repérer dans une représentation. Par exemple, ici, les deux H impliqués dans la LH des deux molécules représentées sont liés à un élément très électronégatif (O) qui porte un doublet non liant (deux dans le cas de la LH inter moléculaire et une dans celui de la LH intra) et l'atome d'H lié à un atome très électronégatif. Donc comment les différencier quand on ne me donne que la formule brute d'une molécule ? La différence de doublets non liants est-elle une caractéristique ?
Dans une correction d'exercice, on me dit que s'il n'y a qu'un seul élément électronégatif alors il s'agit d'une LH intermoléculaire. Or dans les deux représentations j'en vois deux...
-----





