Bonjour à tous, j'aurais besoins d'un peu d'aide pour cet exercice de Dm (je suis en 1ère S) et je ne comprend pas du tout :/
Exercice :
On adapte un manomètre sur un erlenmeyer afin de mesurer la pression de dioxyde de carbone dégagé lors de la réaction entre une masse d’hydrogénocarbonate de sodium , et un volume = 30 mL de solution d’acide chlorhydrique de concentration molaire = 0,5 mol.L-1.
1) Ecrire l’équation de cette réaction acido-basique sachant que l’hydrogénocarbonate de sodium libère, entre autre, des ions sodium et qu’il se forme également de l’eau.
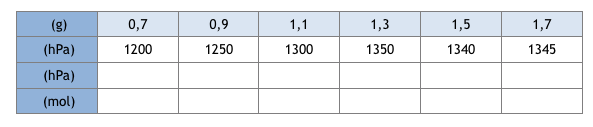
2) On mesure, à l’aide du manomètre, la pression dans l’erlenmeyer lorsque le dégagement gazeux cesse, pour différentes masses d’hydrogénocarbonate de sodium.
La pression initiale de l’air dans le flacon vaut = 1020 hPa.
Le volume occupé par le mélange gazeux vaut 1,1 L et la température ambiante est de 20°C.
Compléter le tableau suivant, en supposant que le dioxyde de carbone est un gaz parfait*:
3) Tracer le graphique représentant la quantité de dioxyde de carbone formé en fonction de la masse . Interpréter les deux parties obtenues.
4) A l’aide d’un tableau d’avancement, déterminer la composition en quantité de matière du système dans l’état final pour = 0,9 g et = 1,5 g. Les quantités de matière de dioxyde de carbone obtenues sont-elle sen accord avec les valeurs déterminées à la question 2*?
Données*:
La pression totale d’un mélange de gaz est égale à la somme des pressions partielles de chaque gaz.
Pour un gaz parfait, il existe la relation*: , avec la pression du gaz, le volume, la quantité de matière de gaz, la constante des gaz parfait égale à 8,314 S.I et la température.
Une réaction acido-basique est un échange de proton entre deux espèces chimiques, l’un acide, l’autre basique.
Merci beaucoup de votre aide !!!
-----



