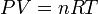Bonjour,
1. Dans la loi
p est en Pa
V en l
n en mol
T en K
et R en J.K^-1.mol^-1
donc une pression par un volume donne une énergie...
J'ai du mal à voir pourquoi...
2. De plus, je ne vois pas comment a été établit expérimentalement ; une loi avec autant de paramètres qui traite d'un modèle théorique....
Prendre un gaz à faible pression et faible température suffit il pour supposer une proportionnalité non observable ?
Cordialement,
-----